Alkyl -Halogenuros -Eigenschaften, erhalten, Beispiele
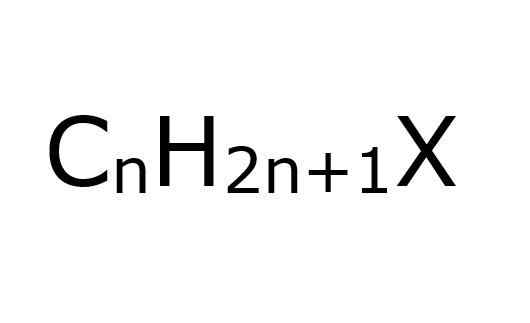
- 1671
- 514
- Rieke Scheer
Der Alkyl -Halogenuros Sie sind organische Verbindungen, bei denen ein Kohlenstoffatom mit SP -Hybridisierung3 Ein Halogen ist kovalent verbunden (F, Cl, Br, I). Aus einer anderen Perspektive ist es bequem, zu vereinfachen, davon auszugehen, dass sie Haloalcanos sind. Dies sind für diejenigen, die einige H -Halogenatome ersetzt wurden.
Auch, wie der Name schon sagt, müssen Halogenatome mit alquilischen Gruppen, R, von dieser Art von Halogenid in Verbindung gebracht werden. Obwohl sie strukturell ersetzt oder verzweigt werden können und aromatische Ringe haben und weiterhin ein Alkylhalogenid sind.
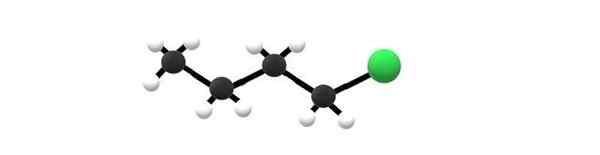 1-Chlorobutano-Molekül, ein Beispiel für ein Alkylhalogenid. Quelle: Gabriel Bolívar.
1-Chlorobutano-Molekül, ein Beispiel für ein Alkylhalogenid. Quelle: Gabriel Bolívar. Oben haben Sie das 1-Chlorobutano-Molekül, das einem der einfachsten Alkylhalogenide entspricht. Es ist ersichtlich, dass alle ihre Kohlenstoffe einfache Bindungen haben und auch SP -Hybridisierung haben3. Daher ist die grüne Kugel, die dem Atom von CL entspricht.
Beispiele, die noch einfacher als 1-Chlorobutano sind, sind diejenigen, die aus Methangas stammen: dem kleinsten Kohlenwasserstoff von allen.
Von seinem Cho -Molekül4 Sie können H -Atome durch Jod ersetzen, um zu sagen. Wenn ein H ersetzt wird, wird das CH sein3Ich (Yodomethan oder Methyliodid). Wenn zwei H ersetzt werden, wird das CH sein2Yo2 (Diyodomethan oder Methyleniodid). Folgte und schließlich ersetze ich alle H -Geben Chi3 (Iodoform) und CI4 (Carbon Tetrayoduro).
Miet -Halogenuros sind durch sehr reaktives und mit den elektronegativsten Atomen der Periodenplatte gekennzeichnet, dass Sinfine durch Mechanismen einen Einfluss auf biologische Matrizen ausüben.
[TOC]
Eigenschaften von Alkyl -Halogenuros
Die Eigenschaften dieser Verbindungsfamilie hängen von ihren molekularen Strukturen ab. Im Vergleich zu denen ihrer Alkane sind jedoch bemerkenswerte Unterschiede, die durch die einfache Tatsache verursacht werden, dass es C-X-Verbindungen gibt (x = Halogenatom).
Das heißt, C-X-Links sind für einen Unterschied oder eine Ähnlichkeit zwischen einem oder mehreren Alkyl-Halogenuros verantwortlich.
Zunächst sind C-H-Glieder aufgrund des niedrigen Elektronegativitätsunterschieds zwischen C und H nahezu apolar; Stattdessen haben C-X-Verbindungen ein dauerhaftes Dipolmoment, da Halogene elektronegativer sind als Kohlenstoff (insbesondere Fluor).
Andererseits sind einige Halogene leicht (F und Cl), während andere schwer sind (Br und I). Seine Atommassen formen auch Unterschiede innerhalb von C-X-Verbindungen; Und wiederum direkt in den Eigenschaften von Halogenid.
Daher ist die Zugabe von Halogenen zu einem Kohlenwasserstoff gleich der Erhöhung seiner Polarität und molekularen Masse; Es ist dasselbe, es (in gewissem Maße) weniger volatil zu machen, weniger brennbar, und die Siede- oder Fusionspunkte zu erhöhen.
Koch- und Fusionspunkte
Das obige wird in zunehmender Reihenfolge in der Größe und damit das Gewicht der verschiedenen Halogene dargestellt:
F < Cl < Br < I
Dann wird erwartet, dass Alkylhalogenide, die F -Atome enthalten.
Zum Beispiel werden einige von Methan abgeleitete Halogenuros berücksichtigt:
CH3F < CH3Cl < CH3Br < CH3Yo
CH2F2 < CH2Cl2 < CH2Br2 < CH2Yo2
Und so weiter für die anderen Derivatesprodukte mit höherem Halogenierungsgrad. Beachten Sie, dass die Reihenfolge beibehalten wird: Fluor -Halogenuros sind leichter als Jod. Nicht nur das, sondern auch seine Siede- und Fusionspunkte folgen dieser Ordnung; Das HF kocht bei niedrigeren Temperaturen als der RI (r = cho3, für diesen Fall).
Kann Ihnen dienen: aromatische elektrophile Substitution: Mechanismus und BeispieleEbenso sind alle diese Flüssigkeiten farblos, da in ihren C-X-Bindungen die Elektronen nicht aufnehmen oder Photonen freisetzen können, um andere Energieniveaus zu bereisen. Wenn sie jedoch schwerer werden, können sie jedoch Farben kristallisieren und zeigen (wie Iodoform, Chi3).
Polarität
C-X-Verbindungen unterscheiden sich von der Polarität, jedoch in umgekehrter Reihenfolge von oben:
C-F> C-Cl> C-BR> C-I
Daher sind C-F-Links polarer als C-I-Links. HF-Halogenuros neigen dazu, durch Dipol-Dipolo-Kräfte zu interagieren. In der Zwischenzeit sind ihre Dipolmomente in den RBR- oder RI -Halogenuros schwächer und die Wechselwirkungen, die den Londoner Dispersionskräften regeln, erlangen größere Stärke.
Lösungsmittelleistung
Da Alkylhalogenide polarer sind als die Alkane, von denen sie abgeleitet sind, erhöhen sie ihre Fähigkeit, eine größere Anzahl organischer Verbindungen aufzulösen. Aus diesem Grund sind sie tendenziell bessere Lösungsmittel; Dies bedeutet jedoch nicht, dass sie die Alkane in allen Anwendungen ersetzen können.
Es gibt technische, wirtschaftliche, ökologische und Leistungskriterien, um ein halogeniertes Lösungsmittel gegenüber einem Alkane zu bevorzugen.
Nomenklatur
Es gibt zwei Möglichkeiten, ein Alkylhalogenid zu nennen: durch seinen gebräuchlichen Namen oder nach seinem systematischen Namen (IUPAC). Bonbonische Namen sind normalerweise wohler, wenn RX einfach ist:
CHCL3
Chloroform: gebräuchlicher Name
Methyl- oder Trichlormethan -Trichlorid: IUPAC -Name.
Die systematischen Namen sind jedoch vorzuziehen (und die einzige Option), wenn sie verzweigte Strukturen haben. Ironischerweise sind gebräuchliche Namen wieder nützlich, wenn Strukturen zu kompliziert sind (z. B. diejenigen, die im letzten Abschnitt zu sehen sind).
Die Regeln, um eine Verbindung gemäß dem IUPAC -System zu benennen. Dann werden Kohlenstoffe ab dem Ende der am nächsten am nächsten gelegenen Substituenten oder Auswirkungen aufgelistet, wobei die alphabetische Reihenfolge benannt wird.
Beispiel
Um es zu veranschaulichen, haben Sie das folgende Beispiel:
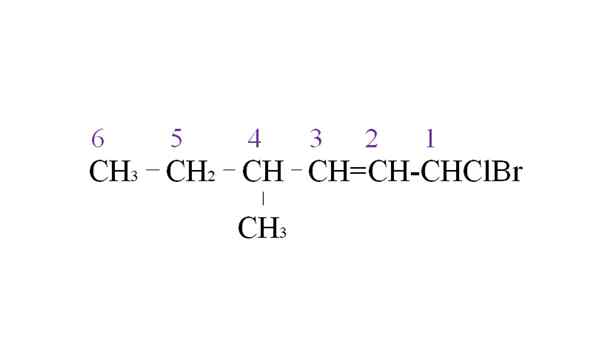 Mieten Sie Halogenid als Beispiel für die Nomenklatur. Quelle: Gabriel Bolívar.
Mieten Sie Halogenid als Beispiel für die Nomenklatur. Quelle: Gabriel Bolívar. Der erste Zweig ist die Methylgruppe im C-4; Aber eine Doppelbindung mit dieser früheren Priorität gegenüber der Regel mitgegeben. Aus diesem Grund beginnt die längste Kette von rechts aufgelistet zu sein, unter der Leitung eines mit zwei Halogenen verbundenen Kohlenstoffatoms: CL und BR.
Mit der Aufzählung werden die Substituenten in alphabetischer Reihenfolge benannt:
1-Brom-1-Clor-4-Methyl-2-Hexen.
Erhalten
Um Alkylhalogenide zu erhalten, müssen Moleküle einem Halogenierungsprozess unterzogen werden. das heißt, Halogenatome in ihre Strukturen einzubeziehen, insbesondere in ein Atom zu einem SP A -Kohlenstoff3.
Es gibt zwei Methoden, um sie zu erhalten oder zu synthetisieren: durch ultraviolette Strahlung durch einen freien Radikalmechanismus oder durch Hinzufügen von Hydracests oder Halogenen.
Halogenierung mit Licht oder ultraviolettem Strahlung
Das erste, das am wenigsten angemessene und mit den schlimmsten Erträgen, besteht darin, Alkane mit ultraviolettem Strahlung zu bestrahlen (Hv) In Gegenwart eines Halogens. Beispielsweise werden die Gleichungen für die Chlorierung von Methan gezeigt:
CH4 + Cl2 => Ch3Cl + HCl (unter ultraviolettem Licht)
CH3Cl + Cl2 => Ch2Cl2 + HCl
CH2Cl2 + Cl2 => CHCL3 + HCl
CHCL3 + Cl2 => Ccl4 + HCl
Die vier Verbindungen (CH3Cl, Ch2Cl2, CHCL3 und Ccl4) Sie werden gebildet, und daher gibt es eine Mischung, die einer fraktionierten Destillation ausgesetzt werden kann. Diese Methode ist jedoch nicht sehr praktisch, und es wird bevorzugt, auf die organische Synthese zurückzugreifen.
Kann Ihnen dienen: Phenylessigsäure: Struktur, Eigenschaften, Verwendungen, EffekteEin weiteres Beispiel ist das der N-Hexan-Bromation:
CH3CH2CH2CH2CH2CH3 + Br2 => Ch3(Br) CHCH2CH2CH2CH3 + HBR
Auch bei dieser Reaktion wird die Licht- oder Ultraviolette Strahlung verwendet, um die Bildung freier Radikale zu begünstigen. Das Brom, wie es eine intensive rote Flüssigkeit ist, wird verteilt, wenn es reagiert, und beobachtet so eine rot bis farbenfrohe Farbporte, wenn sich der 2-Bromhexan verändert.
Zugabe von Hydracests oder Halogenen zu Alkenen
Die zweite Methode, um Alkyl -Halogenuros zu erhalten2C = Cr2) Mit Hydrace. Hydrocide haben eine allgemeine HX -Formel (HF, HCL, HBR und HI). Ein Beispiel wird für jeden von Ethanol angezeigt:
CH3CH2Oh + hf => ch3CH2F + h2ENTWEDER
CH3CH2Oh + hcl => ch3CH2Cl + H2ENTWEDER
CH3CH2Oh + hbr => ch3CH2Br + h2ENTWEDER
CH3CH2Oh + hi => cho3CH2I + h2ENTWEDER
Außerdem können Alkene HX -Moleküle zu ihren Doppelbindungen hinzufügen und sekundäre Alkyl -Halogenuros bilden.
CH2= Ch-ch3 + Hbr => brch2-CH2-CH3 + CH3-CHBR-CH3
Das Brch -Produkt2-CH2-CH3 Es ist der 1-Bromopropano und Cho3-CHBR-CH3 Der 2-Bromopropan. Das zweite ist das Mehrheitsprodukt. Das liegt daran, dass Cho3Chbrch3 Es ist ein sekundäres Alkylhalogenid.
Sehr ähnlich tritt ein X -Molekül auf, wenn das, was dem Alken hinzugefügt wird2:
CH2= Ch-ch3 + Br2 => Brch2-CHBR-CH3
Es wird jedoch ein Alkylhalogenid mit zwei mit benachbarten Kohlenstoffen verbundenen Bromatomen erhalten; Nachbarschaftsalkylhalogenid. Wenn andererseits die beiden mit demselben Kohlenstoff verbundenen Bomos entnommen würden, würde es ein Geminalalkyl -Halogenid wie Folgendes geben:
Br2Ch-ch2-CH3
Reaktionen
Nukleophile Substitution
Die Reaktivitäten der Alkylhalogenide liegen in der Fragilität oder Resistenz des C-X-Zusammenhangs. Je schwerer der Halogen ist, desto schwächer wird die Bindung und daher leichter brechen. In einer chemischen Reaktion werden Links gebrochen und neue gebildet; C-X-Links werden unterbrochen, um einen C-G-Link zu bilden (G = neue Gruppe).
Angemessener fungiert X als ausgehende Gruppe und G als eingehende Gruppe in einer Reaktion von Nukleophile Substitution. Warum geschieht diese Reaktion?? Denn X, der elektronegativer ist als Kohlenstoff, "stiehlt" die elektronische Dichte und hinterlässt ein Elektronendefizit, das als positive teilweise Last bedeutet:
Cδ+-Xδ-
Wenn eine negative Spezies in der Nähe ist (: g-) oder neutral mit einem verfügbaren Elektronenpaar (: g), der in der Lage ist, eine stabilere C-G-Verbindung zu bilden, wird X durch G ersetzt. Das obige kann mit der folgenden chemischen Gleichung dargestellt werden:
Rx +: g- => Rg + x-
Je schwächer die C-X- oder R-X-Verbindung, desto größer ist seine Reaktivität oder Tendenz, die durch die ersetzt werden kann Nukleophiles Mittel (oder Nucleophil) g; Das heißt, Liebhaber von Kernen oder positiven Ladungen.
Beispiele
Eine Reihe allgemeiner Gleichungen für nukleophile Substitutionen, die Alkylhalogenide leiden können, sind nachstehend gezeigt:
Rx + oh- => Roh + x- (Alkohole)
+ Oder''- => Ror'' (Ether, Synthese von Williamson)
+ Yo- => Ri (Alkyl -Yoduros)
+ CN- => Rcn (nitrilos)
+ R'coo- => RCOOR '(ESTERS)
+ NH3 => Rnh2 (Amine)
+ P (c6H5)3 => RP (c6H5)3+ X- (Phosphoniumsalze)
+ Sch- => Rsh (Tioles)
Kann Ihnen dienen: ChemiestufenAus diesen Beispielen können die wertvollen Alkylhalogenide für die organische Synthese vermutet werden. Eine von vielen Substitutionen, die fehlten, ist die Reaktion von Friedel Crafts, mit der aromatischen Ringe "mieten" werden:
Rx + arh + alcl3 => Rra
In dieser Reaktion wird ein h des aromatischen Rings durch eine Gruppe r ersetzt, aus dem RX.
Beseitigung
Miethalogenide können HX -Moleküle durch eine Eliminierungsreaktion freisetzen. Insbesondere eine Dehydrohalogenierung:
R2CH-CXR2 + Oh- => R2C = Cr2 + Hx
Es wird gesagt, dass eine Dehydrohalogenierung auftritt.
Grignard -Reagenzsynthese
Miethalogenide können mit bestimmten Metallen reagieren, die ein Grignard -Reagenz bilden, das zur Aufnahme von R -Gruppen zu anderen Molekülen verwendet wird. Die allgemeine Gleichung seiner Synthese ist wie folgt:
Rx + mg => rmgx
Beispiele
In den Abschnitten wurden bereits mehrere Beispiele für Alkyl -Halogenuros erwähnt. Einige andere sind einfach:
-Ethylchlorid, CH3CH2Cl
-Isopropil Fluoruro (CH3)2CH2F
-2-Methyl-3-Chloropentano, Ch3-Ch (Ch3) -Chcl -ch2CH3
-Secbutilo Yoduro, CH3CH2CH2I-ch3
-3-Brom-6-Iodheptano, Ch3-CH2-CHBR-CH2-CH2-CH2Yo
-3,4-Dibrom-1-Pveno, Ch3-CHBR-CHBR-CH = CH2
Anwendungen
Lösungsmittel
In früheren Abschnitten wurde die Lösungsmittelkapazität von Alkylhalogeniden erwähnt. Aus dieser Eigenschaft hat die Branche sie als Reinigungsmittel ausgewählt, entweder für Textilsache, elektronische Komponenten oder Entfernen von Lackflecken.
Sie werden auch als Lösungsmittel für Gemälde oder organische oder fettliche Proben für unzählige Arten von analytischen Tests verwendet.
Organische Synthese
Miet -Halogenuros sind sehr nützlich, um aromatische Ringe zu "mieten" und gleichzeitig als Ausgangsquelle für die Synthese praktisch aller anderen Familien organischer Verbindungen zu dienen. Synthetisch wird RX als Quelle von Gruppen oder R -Ketten angesehen, die erwünscht werden können, um hoch aromatische Verbindungen zu integrieren.
Pharmaindustrie
Zu Beginn wurde erwähnt, dass Halogenatome mit biologischen Matrizen interagieren. In unseren Organismen können sie nicht unbemerkt bleiben, ohne eine Veränderung zu erzeugen, positiv oder negativ. Wenn ein Medikament einen positiven Einfluss auf den Körper ausübt, kann ein Halogenatom diese Wirkung erhöhen oder auch nicht.
Also, wenn x direkt mit SP -Hybridisierung einen Kohlenstoff mit der SP -Hybridisierung verknüpft ist3, Es wird ein Alkylhalogenid und kein halogeniertes Derivat geben. Einige solcher Halogenuros sind unten in der folgenden Reihe von Bildern gezeigt:
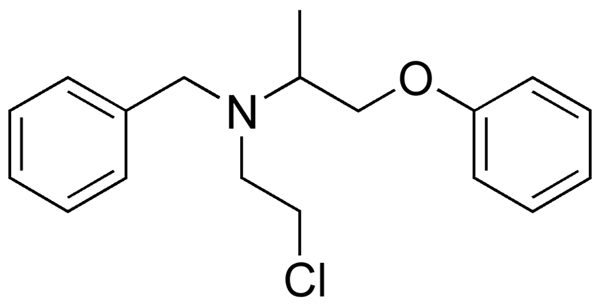 Phenoxibenzamin, ein Medikament zur Kombination des Blutdrucks bei Patienten mit Phäochromozytom. Quelle: UTENNT: Marke markieren [Public Domain].
Phenoxibenzamin, ein Medikament zur Kombination des Blutdrucks bei Patienten mit Phäochromozytom. Quelle: UTENNT: Marke markieren [Public Domain].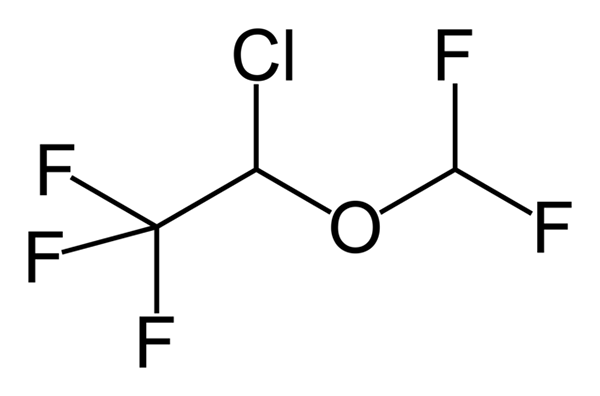 Isoflurano, ein Inhalationsanästhetikum. Quelle: Benjah-BMM27 [Public Domain].
Isoflurano, ein Inhalationsanästhetikum. Quelle: Benjah-BMM27 [Public Domain].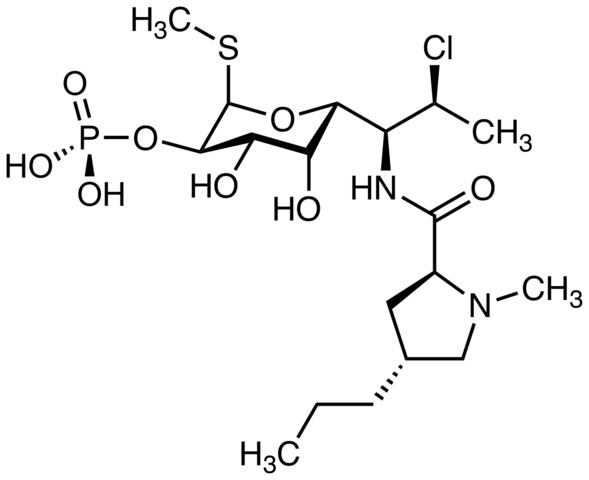 Clindamycin, ein Antibiotikum. Quelle: M Mitcheltrat [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]].
Clindamycin, ein Antibiotikum. Quelle: M Mitcheltrat [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]].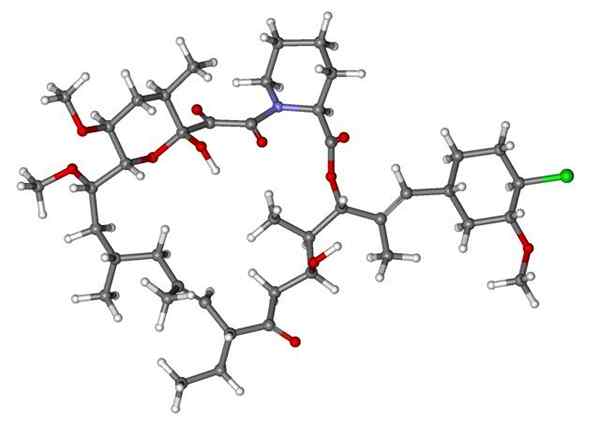 Piecrolimus, der zur Behandlung von atopischer Dermatitis verwendet wird. Können Sie das Chloratom lokalisieren?? Quelle: Marinavladivok [CC0].
Piecrolimus, der zur Behandlung von atopischer Dermatitis verwendet wird. Können Sie das Chloratom lokalisieren?? Quelle: Marinavladivok [CC0]. Halomon, mögliches antitumorale Mittel und Alkylhalogenid der Seetangalgen -Portierien Hornemannii, eine natürliche Quelle. Quelle: Jü [Public Domain]
Halomon, mögliches antitumorale Mittel und Alkylhalogenid der Seetangalgen -Portierien Hornemannii, eine natürliche Quelle. Quelle: Jü [Public Domain]
Beachten Sie, dass es in diesen fünf Medikamenten mindestens einen Link des CHO -Typs gibt2-X oder ch-x; Das heißt, Halogen ist mit einem SP -Carbon verbunden3.
Kältemittel
Das berühmte Kältemittel Freón-12 (Chcif2)) Wie andere Fluorcanos oder Hydrofluorkohlenwasserstoffe ersetzten sie in dieser Funktion Ammoniak und Chlorfluorkohlenwasserstoffe (CFCs), da sie sogar nicht -flüchtige oder giftige Substanzen die Ozonschicht zerstörten; Während Freón-12, weil es reaktiver ist, zerstört wird, bevor er solche Höhen erreicht.
Verweise
- Carey f. (2008). Organische Chemie. (Sechste Ausgabe). Mc Graw Hill.
- Clark Jim. (14. Juli 2016). Verwendung von Alkylhältern. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Gál, b., Bucher, c., & Burns, n. Z. (2016). Chirale Alkylhalogenide: Unerforte Motive in der Medizin. Marine Drugs, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkylhalogenide. Abgerufen von: Chemed.Chem.Purdue.Edu
- Patkar Prachi. (16. Juli 2017). Alles über Alkylhalogenide: Eigenschaften, Verwendung und vieles mehr. Wissenschaftsstruktur. Erholt von: Sciencestruck.com
- R. Schiff. (2016). Alkylhalogenide. Erholt von: Hyperphysik.Phy-astr.GSU.Edu
- Lernhandbuch für Kapitel 9 - Alkylhalogenide i. Erholt von: Kaktus.Dixie.Edu
- Q.ZU. Eduardo Vega Barrios. (S.F.). Mieten Sie Halogenuros: Eigenschaften, Verwendungen und Anwendungen. [PDF. Erholt von: cVonline.UAEH.Edu.mx
- « Strukturstruktur der Lustsäure (HNO2), Eigenschaften, Synthese
- Lithiumbromidstruktur, Eigenschaften, Verwendungen, Risiken »

