Helio -Geschichte, Eigenschaften, Struktur, Risiken, verwendet

- 3617
- 978
- Tizian Liebich
Er Helium Es ist ein chemisches Element, dessen Symbol ist. Dies ist das erste edle Gas im Periodensystem und befindet sich normalerweise am Ende desselben. Unter normalen Bedingungen handelt es sich um ein inertes Gas, da keine seiner wenigen Verbindungen stabil ist; Es dehnt sich auch sehr schnell aus und ist die Substanz mit dem geringsten Siedepunkt von allen.
Auf der beliebten Ebene ist es ein gut bekanntes Gas, da es bei unzähligen Ereignissen oder Kinderparteien häufig ist. Was jedoch wirklich und für immer für die Ecken des Sonnensystems verloren geht, und darüber hinaus sind sie die Heliumatome, die freigelassen werden, sobald der Globus zerbrochen ist.
 Mit Helium aufgeblähte Luftballons, die in alltäglichen Situationen am nächsten sein kann, kann dieses Elements sein. Quelle: Pixabay.
Mit Helium aufgeblähte Luftballons, die in alltäglichen Situationen am nächsten sein kann, kann dieses Elements sein. Quelle: Pixabay. Tatsächlich gibt es diejenigen, die und aus großer Grund glauben, dass Heliumballons eine unangemessene Praxis für dieses Gas darstellen. Zum Glück hat es dank seiner physikalischen und chemischen Eigenschaften, die es von anderen chemischen Elementen trennen.
Zum Beispiel ist flüssiges Helium so kalt, dass es als Metalllegierung alles einfrieren kann, was es zu einem Superkonferenzmaterial macht. Es ist auch eine Flüssigkeit, die Superfluidität manifestiert und in der Lage ist, die Wände eines Glasbehälters zu besteigen.
Sein Name liegt daran, dass er zum ersten Mal in der Sonne identifiziert wurde und nicht auf der Erde. Es ist das zweithäufigste Element im gesamten Universum und obwohl seine Konzentration in der Erdkruste lächerlich ist, kann es aus den Reserven von Erdgas und radioaktiven Mineralien von Uran und Thorium erhalten werden.
Hier zeigt das Helium eine weitere merkwürdige Tatsache: Es ist ein Gas, das im Untergrund viel mehr gibt als in der Atmosphäre, wo es letztendlich aus der Erde und ihrem Gravitationsfeld entkommt.
[TOC]
Geschichte
Das Helium wurde auf der Erde nicht entdeckt, sondern in der Sonne. Tatsächlich stammt sein Name aus dem griechischen Wort "Helios", was Sonne bedeutet. Die Existenz des Elements allein stellte die periodische Tabelle von Dmitri Mendeléyev gegenüber, da es keinen Platz für ein neues Gas gab; Das heißt, bis dahin gab es absolut nichts über edle Gase.
Der Name 'Helio', der in englischer Sprache als "Helium" geschrieben wurde, endete mit dem Suffix, das sich als Metall bezeichnete; Gerade weil die Existenz eines anderen Gas außer Sauerstoff, Wasserstoff, Fluor, Chlor und Stickstoff nicht zugelassen werden konnte.
Dieser Name wurde vom englischen Astronom Norman Lockyer bezeichnet, der aus England studierte, was vom französischen Astronom beobachtet wurde.
Es war bis dahin eine gelbe spektrale Linie eines unbekannten Elements. Lockyer sagte, dass dies auf das Vorhandensein eines neuen chemischen Elements in der Sonne zurückzuführen sei.
Im Jahr 1895, fast zwanzig Jahre später, erkannte der schottische Chemiker Sir William Ramsay das gleiche Spektrum aus einem verbleibenden Gas beim Studium eines radioaktiven Minerals: Cleveíta. Deshalb gab es hier auch Helio.
Physikalische und chemische Eigenschaften
Aussehen
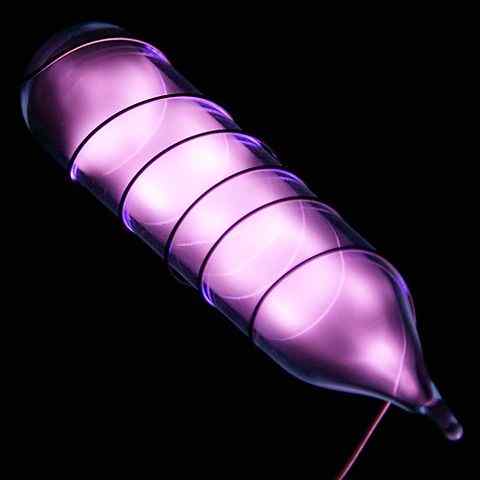 Ampulle mit einer Heliumprobe nach einem elektrischen Stoß. Quelle: Hi-Res-Bilder chemischer Elemente [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Ampulle mit einer Heliumprobe nach einem elektrischen Stoß. Quelle: Hi-Res-Bilder chemischer Elemente [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Helium ist ein farbloses, geruchloses Gas, das keinen Geschmack hat und auch inert ist. Wenn jedoch ein Elektroschock aufgetragen wird und abhängig von der Spannungsdifferenz beginnt er wie ein grau-moralischer Nebel (oberes Bild) zu glänzen, um dann mit einem orangefarbenen Glanz zu leuchten. Daher sind Heliumlichter orange.
Atomnummer (z)
2
Molmasse
4,002 g/mol
Schmelzpunkt
-272,2 ºC
Siedepunkt
-268,92 ºC
Dichte
-0,1786 g/l unter normalen Bedingungen, dh in einer Gasphase.
-0,145 g/ml am Schmelzpunkt das flüssige Helium.
-0,125 g/ml, gerade dann, wenn das Helium zu kochen beginnt.
-0,187 g/ml, bei 0 K und 25 atm, dh festes Helium zu diesen spezifischen Druck- und Temperaturbedingungen.
Dreifacher Punkt
2.177 K und 5.043 kPa (0,04935 atm)
Kritischer Punkt
5,1953 K und 0,22746 MPa (2.2448 atm)
Fusionshitze
0,0138 kJ/mol
Verdampfungswärme
0,0829 kJ/mol
Molarenwärmekapazität
20.78 J/(mol · k)
Dampfdruck
0,9869 atm bei 4,21 k. Dieser Wert dient dazu, eine Vorstellung davon zu geben, wie Flotte.
Ionisationsenergien
-Erstens: 2372.3 kJ/mol (er+ gasförmig)
-Zweitens: 5250,5 kJ/mol (er2+ gasförmig)
Ionisierungsenergien für Helium sind besonders hoch, da das Gasatom ein Elektron verlieren muss, das eine starke wirksame Kernbelastung aufweist. Es kann auch verstanden werden, ob die geringe Größe des Atoms berücksichtigt wird und wie „nah“ die beiden Elektronen in Bezug auf den Kern sind (mit ihren beiden Protonen und zwei Neutronen).
Löslichkeit
Im Wasser sind 0,97 ml pro 100 ml Wasser bei 0 ºC gelöst, was bedeutet, dass es wenig löslich ist.
Kann Ihnen dienen: AmmoniumoxalatReaktivität
Helium ist das zweitgrößte reaktive chemische Element in der Natur. Unter normalen Bedingungen ist es erfolgreich zu bestätigen, dass es sich um ein inertes Gas handelt. Niemals (für das, was es scheint) kann eine Heliumverbindung in einem Raum oder einem Labor manipuliert werden, ohne dass enorme Drucke darauf wirken. Oder vielleicht dramatisch hohe oder niedrige Temperaturen.
Ein Beispiel, das wir in der NA -Verbindung sehen2Er, der nur unter Druck von 300 GPa stabil ist und in einer Diamant -Yunque -Zelle reproduziert wird.
Während die chemischen Bindungen in der NA2Haben Sie "Fremde", um ihre Elektronen in den Kristallen gut zu befinden, sie sind alles andere als einfache Wechselwirkungen von Van der Wänden und bestehen daher nicht einfach aus Heliumatomen, die von molekularen Aggregaten gefangen sind. Hier ist das Dilemma, zwischen dem Heliumverbindungen real sind und was nicht.
Zum Beispiel können Stickstoffmoleküle zu hohen Drücken ein Helium -Atom einsperren, um eine Art Klappern zu verursachen2)elf.
Außerdem gibt es Endo -Subverting -Komplexe von Fulleren -Kationen, C60+N und C70+N, in wessen Hohlräume können sie Heliumatome unterbringen; und die molekulare Kation heh+ (He-h+), gefunden in sehr entfernten Nebeln.
Oxidationszahl
Wer aus Neugier versucht, die Oxidationszahl für Helium in einer seiner Verbindungen zu berechnen, wird feststellen, dass dies gleich 0 ist. In der Na2Er konnte zum Beispiel gedacht werden, dass seine Formel hypothetischen Na -Ionen entspricht2+Er2-; Dies wäre jedoch zu gehen, dass er einen reinen ionischen Charakter hat, wenn seine Verbindungen in Wirklichkeit weit davon entfernt sind.
Darüber hinaus gewinnt Helium keine Elektronen, da es sie nicht in den 2S -Orbital -, nicht verfügbaren Energie aufnehmen kann. Und es ist auch nicht möglich, dass Sie sie aufgrund der reduzierten Größe seines Atoms und der großen effektiven nuklearen Belastung seines Kerns verlieren. Deshalb nimmt Helium immer (theoretisch) als Atom teil0 In seinen abgeleiteten Verbindungen.
Elektronische Struktur und Konfiguration
Das Helium nimmt wie alle in einer Makroescala beobachteten Gase das Volumen der Behälter ein, die sie speichern, und haben somit einen unbestimmten Weg. Wenn die Temperatur jedoch abfällt und sich unter -269 ° C abkühlt, kondensiert das Gas in einer farblosen Flüssigkeit; Das Helium I, das erste der beiden flüssigen Phasen für dieses Element.
Der Grund, warum das Helium bei einer so niedrigen Temperatur kondensiert, liegt auf den wenigen Dispersionskräften, die ihre Atome zusammenhalten. Was auch immer die Phase in Betracht gezogen wird. Dies kann aus seiner elektronischen Konfiguration erklärt werden:
1s2
In denen zwei Elektronen das 1S -Atom -Orbital einnehmen. Heliumatom kann als fast perfekte Kugel sicht.
Somit sind spontane und induzierte Dipolmomente selten und sehr schwach; Daher muss sich die Temperatur dem absoluten Null nähern, so dass sich die Atome ausreichend Langsamkeit näherten und ihre dispersiven Kräfte eine Flüssigkeit definieren lassen; Oder noch besser ein Heliumglas.
Dimere
In der gasförmigen Phase hat der Raum, der die Atome trennt. So sehr, so dass das Helium in einem Blasen von wenig Volumen farblos aussieht, bis es einem elektrischen Schock ausgesetzt ist, der seine Atome in einem grauen und kleinen hellen Nebel ionisiert.
In der flüssigen Phase haben die Atome jedoch auch bei ihren schwachen Wechselwirkungen nicht mehr "länger ignorieren". Jetzt erlaubt es ihnen die Dispersionskraft2. Deshalb können Sie Helium i als riesige Cluster von ihm vorstellen2 im Gleichgewicht mit seinen Dampfphasenatomen.
Deshalb ist Helium I so schwer von seinen Dämpfen zu unterscheiden. Wenn diese Flüssigkeit außerhalb ihres hermetischen Behälters verschüttet wird, entkommt sie wie eine weißliche Fackel.
Helio II
Wenn die Temperatur noch mehr sinkt und die 2.178 K (-270,972 ° C) berührt, tritt ein Phasenübergang auf: Helium I wird in Helium II umgewandelt.
Ab diesem Zeitpunkt wird die faszinierende Heliumflüssigkeit zu einer überflüssigen oder Quantenflüssigkeit; Das heißt, seine makroskopischen Eigenschaften manifestiert2 Sie waren einzelne Atome (und vielleicht sind sie es). Es fehlt eine vollständige Viskosität, da es keine Oberfläche gibt, die ein Atom während seines Gleitens oder "Klettern" stoppen kann.
Deshalb kann Helio II durch die Wände eines Glasbehälters aufsteigen, der die Schwerkraft überwindet. unabhängig davon, wie hoch sie sind, solange die Oberfläche bei der gleichen Temperatur bleibt und daher nicht volatisieren.
Es kann Ihnen dienen: Hypophysensäure (H3PO2): Eigenschaften, Verwendung und ReagenzienAus diesem Grund kann das flüssige Helium nicht in Glasbehältern gelagert werden, da es vor der geringsten Fissur oder Lücke entweichen würde; Sehr ähnlich wie es mit einem Gas passieren würde. Stattdessen wird Edelstahl verwendet, um diese Behälter zu entwerfen (Dewars -Tanks).
Kristalle
Obwohl die Temperatur bis 0 K (die absolute Null) abfällt, wäre die Dispersionskraft zwischen den Atomen nicht stark genug, um sie in einer kristallinen Struktur zu ordnen. Um Verfestigung vorzunehmen, muss sich der Druck auf ungefähr 25 atm erhöhen. Und dann erscheinen kompakte hexagonale Kristalle (HCP).
Geophysikalische Studien zeigen, dass diese HCP -Struktur bei weitem unverändert bleibt, dass der Druck erhöht wird (bis in die Größenordnung der Pascal Giga, GPA). Es gibt jedoch einen schmalen Bereich in seinem Drucktemperaturdiagramm, in dem diese HCP-Kristalle einen Übergang zu einer Kubikphase auf dem Körper (BCC) erleiden.
Wo ist es und erhalten
Kosmos und Steine
 Das Helium repräsentiert das zweithäufigste Element des Universums und 24% seiner Masse. Quelle: pxhere.
Das Helium repräsentiert das zweithäufigste Element des Universums und 24% seiner Masse. Quelle: pxhere. Helium ist das zweithäufigste Element im gesamten Universum, das nur durch Wasserstoff übertroffen wird. Die Sterne produzieren ständig unermessliche Mengen von Heliumatomen, indem sie zwei Wasserstoffkerne während des Nucleosyntheseprozesses zusammenschließen.
Ebenso ist jeder radioaktive Prozess, der α -Partikel emittiert, eine Produktionsquelle von Heliumatomen, wenn sie mit den Elektronen der Umwelt interagieren. Zum Beispiel mit denen eines Steinkörpers in Tanks radioaktiver Mineralien von Uran und Thorium. Diese beiden Elemente erleiden radioaktive Zerfall, beginnend mit Uran:
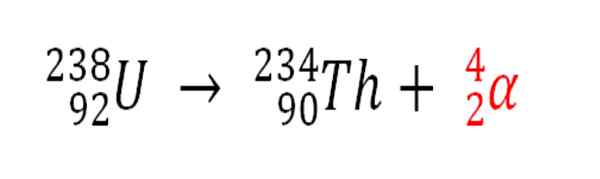 Radioaktiver Zerfall im Uran in der Bildung von Alfas -Partikeln, die sich anschließend in Helium -Atom in unterirdischen Ablagerungen verwandeln. Quelle: Gabriel Bolívar.
Radioaktiver Zerfall im Uran in der Bildung von Alfas -Partikeln, die sich anschließend in Helium -Atom in unterirdischen Ablagerungen verwandeln. Quelle: Gabriel Bolívar. Daher werden in den Felsen, in denen diese radioaktiven Mineralien konzentriert sind.
Zu einigen dieser Mineralien zählen Cleveíta, Carnotita und Uraninit, die alle aus Uranoxiden bestehen (UO2 oder u3ENTWEDER8) und Verunreinigungen von Thorium, Schwermetallen und Seltenen Erden. Das Helium, das durch unterirdische Kanäle bewässert wird, kann sich in Erdgasreservoirs, Mineralfedern oder in meteorischen Eisen ansammeln.
Es wird geschätzt, dass jährlich ein Heliummasse entspricht, der 3000 Tonnen entspricht, aus dem radioaktiven Zerfall von Uran und Thorium.
Luft und Meere
Das Helium ist im Wasser nicht sehr löslich, so früher und später, es kommt aus den Tiefen (wo sich sein Ursprung gefunden hat), um die Schichten der Atmosphäre zu überqueren und schließlich den sideralen Raum zu erreichen. Seine Atome sind so klein und leicht, dass das Gravitationsfeld der Erde sie nicht in der Atmosphäre behalten kann.
Aufgrund des oben genannten.
Wenn Sie aus einem dieser beiden Medien extrahieren möchten, wäre die "beste" Option die Luft, die sie zunächst einer Verflüssigung einreichen müsste, um alle Komponentengase zu kondensieren, während das Helium in einem gasförmigen Zustand bleibt.
Es ist jedoch nicht praktisch, Helium aus der Luft zu erhalten, sondern aus den mit radioaktiven Mineralien angereicherten Felsen. Oder noch besser Erdgasreserven, wo Helium bis zu 7% seiner Gesamtmasse ausmachen kann.
Erdgas -Verflüssigung und Destillation
Anstatt die Luft auszusetzen, ist es einfacher und profitabler. Daher ist der Rohstoff Par Exzellenz (kommerziell), um Helium zu erhalten.
Das Endprodukt der Destillation wird mit aktiviertem Kohlenstoff fertiggestellt, der durch ein großes Reinheit Helium fließt. Und schließlich trennt sich Helium durch einen kryogenen Prozess, bei dem flüssiges Helium verwendet wird.
Isotope
Helium wird in der Natur vorwiegend als Isotop vorgestellt 4Er, dessen nackter Kern das berühmte Teilchen α ist. Dieses Atom von 4Ich habe zwei Neutronen und zwei Protonen. In geringerer Häufigkeit ist das Isotop 3Er, der nur ein Neutron hat. Der erste ist schwerer (es hat eine größere Atommasse) als die zweite.
Somit das Isotopepaar 3Er und 4Haben diejenigen, die die mesurablen Eigenschaften definieren und was wir von Helium als chemisches Element verstehen. Seit der 3Er ist leichter, es wird angenommen, dass ihre Atome mehr kinetische Energie haben und dass sie daher eine noch geringere Temperatur benötigen.
Er 3Ich habe hier auf der Erde eine sehr seltene Art betrachtet. In Mondböden ist es jedoch häufiger (ungefähr 2000 Mal). Deshalb wurde der Mond Projekte und Geschichten als mögliche Quelle von unterzogen 3Er, der als Kernbrennstoff für das Raumschiff der Zukunft genutzt werden könnte.
Kann Ihnen dienen: reine SubstanzenUnter anderen Helium -Isotopen können mit ihren jeweiligen halben Lebenszeiten erwähnt werden: 5ER (T1/2= 7,6 · 10–22 S), 6ER (T1/2= 0,8 s) und 8ER (T1/2= 0,119 s).
Risiken
Helium ist ein inerter Gas und beteiligt sich daher nicht an den Reaktionen, die in unserem Körper auftreten.
Seine Atome treten praktisch ein und werden ohne ihre Wechselwirkungen mit Biomolekülen ausgeatmet, die einen nachfolgenden Effekt erzeugen; Außer im Klang, der von den Stimmbändern emittiert wird, die akuter werden und mehr Frequenz aufweisen.
Menschen, die Helio eines Ballons einatmen (in Maßen), sprechen mit einer akuten Stimme, ähnlich der eines Eichhörnchens (oder Ente).
Das Problem liegt in der Tatsache, dass, wenn die Person eine unangemessene Menge an Helium einatmet, das Risiko von Erstickungsläufen, da ihre Atome zu Sauerstoffmolekülen wechseln; Und deshalb kann es nicht atmen können, bis alles, was Helium ausatmet, was wiederum aufgrund seines Drucks das Lungengewebe reißen oder Barotraumas verursachen kann.
Fälle von Menschen, die an Inhalle Helio gestorben sind.
Andererseits kann, obwohl es ein Brandrisiko angesichts seiner mangelnden Reaktivität gegenüber Sauerstoff (oder einer anderen Substanz) nicht darstellt.
Anwendungen
Helios physikalische und chemische Eigenschaften machen es nicht nur zu einem speziellen Gas, sondern auch zu einer sehr nützlichen Substanz für Anwendungen, die die Temperaturen in extrem niedrigen Verdiensten verdienen. In diesem Abschnitt werden einige dieser Anwendungen oder Verwendungen behandelt.
Druck- und Spülsysteme
In einigen Systemen ist es notwendig, den Druck zu erhöhen (Druck), und dafür muss es injiziert oder versorgt werden, die mit keinem seiner Komponenten interagieren. Zum Beispiel mit Reagenzien oder Oberflächen, die für unerwünschte Reaktionen empfindlich sind.
Somit kann der Druck mit Heliumvolumina erhöht werden, deren chemische Trägheit ihn für diesen Zweck ideal macht. Die inerte Atmosphäre, die in bestimmten Fällen von Stickstoff übertrifft.
Für den umgekehrten Prozess, dh die Spülung, wird auch Helium verwendet. Auf diese Weise wird der Systemdruck verringert, sobald das Helium geleert wurde.
Leckerkennungen
Das Helium kann durch die geringste Fissur filtriert werden, sodass es auch dazu dient.
Manchmal kann die Erkennung visuell oder mit Berührung erfolgen; Meistens ist jedoch ein Detektor das Signal, wo und wie viel Helium dem inspizierten System entkommt.
Ziehengas
Heliumatome, wie für Säuberungssysteme erwähnt, können es abhängig von Ihrem Druck, schwereren Molekülen, ziehen. Zum Beispiel wird dieses Prinzip täglich in der Gaschromatographieanalyse verwendet, da es die Probe entlang der Säule ziehen kann, wo es mit der stationären Phase interagiert.
Luftballons und Luftschiffe
 Helium wird verwendet, um die Luftschiffe aufzublasen und ist viel sicherer als Wasserstoff, da es kein brennbares Gas ist. Quelle: Pixabay.
Helium wird verwendet, um die Luftschiffe aufzublasen und ist viel sicherer als Wasserstoff, da es kein brennbares Gas ist. Quelle: Pixabay. Aufgrund seiner geringen Dichte im Vergleich zu Luft und wiederum zu seiner mangelnden Reaktivität mit Sauerstoff wurde es verwendet, um Luftballons auf Kinderparteien aufzublasen (gemischt mit Sauerstoff, so dass niemand zum Atmen erstickt ist) und Luftschiffe (überlegenes Bild) (überlegenes Bild). , ohne in der Lage zu sein, ein Feuerrisiko darzustellen.
Tauchen
 Das Helium ist eine der Hauptbestandteile der Sauerstofftanks, mit denen die Taucher atmen. Quelle: pxhere.
Das Helium ist eine der Hauptbestandteile der Sauerstofftanks, mit denen die Taucher atmen. Quelle: pxhere. Wenn die Taucher in größere Tiefen absteigen, fällt es ihnen schwierig, durch den großen Druck vom Wasser zu atmen. Deshalb wird Helio in seinen Sauerstofftanks hinzugefügt, um die Dichte des Gases zu verringern, das die Taucher atmen und ausatmen, und daher kann es mit weniger Arbeit ausgeatmet werden.
Lichtbogenschweißen
Im Schweißprozess bringt der elektrische Bogen genügend Wärme, damit die beiden Metalle verbunden sind. Wenn das Glühlmetall unter einer Heliumatmosphäre durchgeführt wird, reagiert es nicht mit dem Sauerstoff der Luft, um sein jees Oxid zu werden. Daher verhindert Helium, dass dies geschieht.
Superkonferenzen
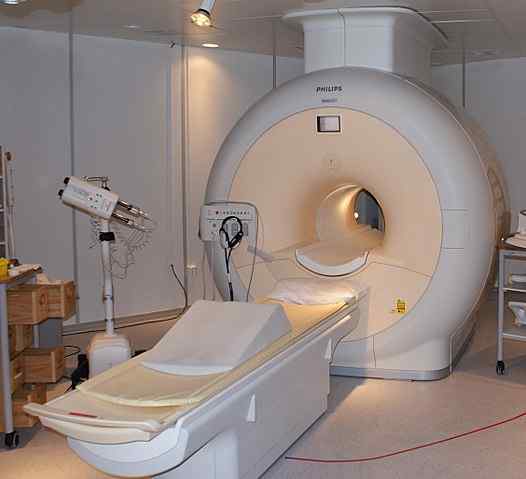 Flüssiges Helium wird verwendet, um die in den Scannern der nuklearen Magnetresonanztomographie verwendeten Magnete zu kühlen. Quelle: Jan Ainali [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]]
Flüssiges Helium wird verwendet, um die in den Scannern der nuklearen Magnetresonanztomographie verwendeten Magnete zu kühlen. Quelle: Jan Ainali [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)]] Flüssiges Helium ist so kalt, dass es Metalle einfrieren kann, um sie in Supraleiter umzuwandeln. Dank diesem wurden sehr leistungsstarke Magnete hergestellt, die in Bildern von Bildern oder Spektrometern der nuklearen Magnetresonanz in Bildern von Bildern oder Spektrometern verwendet wurden.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Andy Estance. (17. April 2019). Heliumhydridion Ion erstmals im Weltraum nachgewiesen: Beweise für die schwer fassbare Chemie aus den ersten Minuten des Universums gefunden. Erholt von: Chemistryworld.com
- Peter Wothers. (19. August 2009). Helium. Chemie in ihrem Element. Erholt von: Chemistryworld.com
- Wikipedia. (2019). Helium. Abgerufen von: in.Wikipedia.Org
- Mao, h. K., Wu und., Jephcoat, a. P., Hemley, r. J., Bell, p. M., & Bassett, w. ZU. (1988). Kristallstruktur und Dichte von Helium bis zu 232 kbar. Abgerufen von: Artikel.Adsabs.Harvard.Edu
- Nationales Zentrum für Biotechnologie Information. (2019). Helium. Pubchem -Datenbank. CID = 23987. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Mary-Ann Muffoletto. (6. Februar 2017). Up, Up und Away: Chemiker sagen "Ja", Helium kann Verbindungen bilden. Utah State University. Erholt von: phys.Org
- Steve Gagnon. (S.F.). Isotope des Elements Helium. Jefferson Lab. Erholt von: Bildung.JLAB.Org
- Advameg, Inc. (2019). Helium. Erholt von: ChemistryExplaed.com

