Hämoolis -Eigenschaften, Arten, Wirkungsmechanismen
- 3015
- 375
- Lewis Holzner
Der Hämoolisine Es ist ein kleines Protein, das Poren in der Zellmembran von Erythrozyten und einigen anderen Zellen des Blutes von Säugetieren verursacht. Es wird im Allgemeinen synthetisiert und von pathogenen Bakterien ausgeschieden.
Dieses Protein ist eines der häufigsten mikrobiellen Toxine und derjenige, der am besten untersucht wurde. Manchmal kann es eine hämolytische Anämie verursachen, da die Anzahl der Kanäle, durch die das Zellintern herauskommt, sogar Zelllyse verursachen kann.
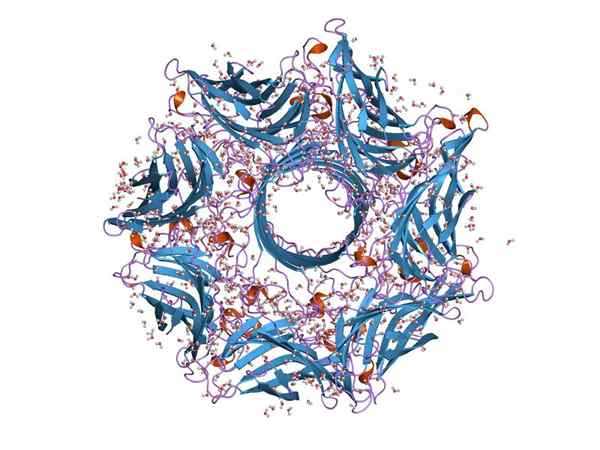
 Molekulare Struktur einer Hämoolisine (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Molekulare Struktur einer Hämoolisine (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Im Allgemeinen ist Hämoolisine ein typisches Toxin der Art von Streptococcus des Darmtrakts. Seine Funktion ermöglicht es Bakterien, die epitheliale Barriere des Darmtrakts zu brechen und sich so durch den Blutkreislauf zu bewegen, um andere Gewebe zu besiedeln.
Die häufigste Art, wie sich Hämoolisine in der Natur befindet. Dieses Protein ist einer der wichtigsten Virulenzfaktoren der meisten Stämme von Escherichia coli und einige Clostide.
Die meisten Harnwegsinfektionen werden durch Stämme von verursacht Escherichia coli das erzeugt α-Hemolisin mit hämolytischen Eigenschaften.
Die Produktion von Hämoolisine und Bakteriocin wurde mit Bakterienstämmen mit einem Kompetenzmechanismus gegen andere Arten zusammenhängen, und die Produktion beider Toxine scheint von denselben genetischen Determinanten im Bakteriengenom abzuhängen.
[TOC]
Eigenschaften
Hämoolisine besteht aus sieben Untereinheiten und dem Gen, das codiert, hat sieben Promotoren. Diese sieben Untereinheiten werden in die Plasmamembran der weißen Zellen eingeführt und bilden, wenn sie zusammen einen ionischen Kanal bilden, in dem die Metaboliten des Zellinnens entkommen.
Hämoolisine ist Calcium -abhängiges Cytotoxin (Ca+2) extrazellulär, der auf die Plasmamembran von Blutströmen wirkt. Die Poren, die in der Membran erzeugen.
Es kann Ihnen dienen: Unaporto: Transport durch Membranen, EigenschaftenHämoolis sind Proteinprodukte, die für bakterien von gramnegativen Typen typisch sind, und alle haben zwei Merkmale:
1- Das Vorhandensein eines sehr kleinen Peptid. Die Nichtapapéptide von Hämoolisien befinden sich in der Nähe des C-terminalen Teils der primären Proteinstruktur.
2- Alle Hämoolisins werden vom Bakterium durch einen ABC-Typtransporter (aus der englischen ATP-bindenden Kassette) zum extrazellulären Medium ausgeschieden (aus der englischen ATP-bindenden Kassette).
Hämoolisinen werden normalerweise in bakteriellen Stämmen durch Wachstum in der Mitte des Blutagars nachgewiesen. Im Test wird ein hämolytischer Halo beobachtet, Produkt des Bruchs der roten Blutkörperchen in der Nähe der Bakterienkolonien.
Leute
Es gibt verschiedene Arten von Hämoolis, diese werden zu Beginn ihres Namens mit einem griechischen Buchstaben eingestuft. Die am häufigsten untersuchten und häufig Staphylococcus aureus.
Hämoolisine -Typen werden nach dem Bereich der Zellen klassifiziert, die angreifen, und entsprechend ihrer primären Proteinstruktur.
α-Hämolisin
Dieses Protein ist typisch für die Stämme von Staphylococcus aureus Und Escherichia coli; Angriffe Neutrophile, rote Blutkörperchen, Lymphozyten, Makrophagen, erwachsene und embryonale Fibroblasten. Interagieren.
β-Hemolisin
Produziert von Staphylococcus aureus Zu einem geringeren Anteil als α-Hämolisin greift β-Hemolisin hauptsächlich Erythrozyten an und ist in der Membran ausschließlich durch reichhaltige Domänen in der Sphingomyeline der Zellmembran intern.
γ-Hemolisin
Es wurde auch in beobachtet Staphylococcus aureus. Es wurde gleichzeitig als hämolytisches Protein und Leukotoxin klassifiziert, da es polymorphkernige Zellen von Menschen, Monozyten, Makrophagen und selten selbst für die roten Blutkörperchen beeinflusst.
Diese Art von γ-Hämolisin ist einer der am wenigsten charakterisierten, daher war ein Großteil ihres Wirkungsmechanismus unbekannt und dies wurde nicht untersucht In vivo.
Kann Ihnen dienen: Osteoblasten: Training, Merkmale, Funktionen, PathologienAktionsmechanismen
Der relativ deutliche Wirkmechanismus ist der von α-Hämolisin. Da jedoch alle hämolytische Proteine sind, wird angenommen, dass die meisten Prozesse für alle Hämolysine häufig sind.
Wissenschaftler schlagen vor, dass sie für Bakterien die Hämoolisine in die Umwelt trennen müssen, in einer Nährstoffmikroumgebung. Daher wäre dies ein Mechanismus, der die Zelle auslöst, um Weißzellen zu zerstören und ihre Nährstoffe zu erhalten.
Der Mechanismus wurde in drei Schritten beschrieben: der Vereinigung zur Zellmembran, der Insertion und der Oligomerisierung.
Membrane Union
Es wurde festgestellt, dass Hämoolisine die Integrine von Neutrophilen und in Erythrozyten anschließen können.
Einige Autoren schlagen vor, dass das Vorhandensein von Rezeptoren in der Membran für die Vereinigung von Hämolysins nicht wesentlich ist. In jedem Fall ist der Mechanismus des rekonflikten zellulären Proteins noch nicht genau bekannt.
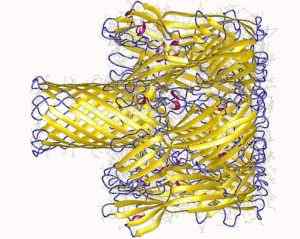 Transmembranale Pore, gebildet durch Staphylococcus hämoolisine Protein (Quelle: Ablagerungsautoren: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.UND.; Visualisierungsautor: Benutzer: Astrojan [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] über Wikimedia Commons)
Transmembranale Pore, gebildet durch Staphylococcus hämoolisine Protein (Quelle: Ablagerungsautoren: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.UND.; Visualisierungsautor: Benutzer: Astrojan [CC von 3.0 (https: // creativecommons.Org/lizenzen/bis/3.0)] über Wikimedia Commons) Die Wechselwirkung mit der Membran erfolgt in zwei Schritten:
- Anfangsvereinigung (reversibel): Wenn die Hämoolisine an die Membran -Calcium -Übergangsdomänen bindet. Dieser Schritt tritt auf der Oberfläche auf und ist sehr anfällig für elektrostatische Entladungen.
- Irreversible Vereinigung: Buchen Sie die Aminosäure -Domänen mit den Lipidkomponenten der äußeren Schicht der Plasmamembran der weißen Zellen, um physikalische Gewerkschaften zwischen den hydrophoben Verbindungen der Membran zu bilden.
Kann Ihnen dienen: ZellwandEinfügen von Toxin in die Membran
Α-Hemolisin-Einsätze Abfall 177 und 411 im ersten Lipidmonoschicht. In dem extrazellulären Medium ist Hämoolisine mit Calciumionen verbunden, die in dieser.
Diese Einfügung konsolidiert die irreversible Vereinigung zur Zellmembran. Sobald die Anordnung aufgetreten ist, wird Hämoolisine zu einem integralen Protein, da experimentell gezeigt wurde, dass die einzige Möglichkeit, es aus der Membran zu extrahieren.
Oligomerisierung
Wenn die gesamte Hämoolisine in die Plasmamembran der weißen Zelle eingeführt wurde.
Es wurde beobachtet, dass der Oligomerisierungsprozess durch Mikrodominien oder Lipidbalsas der Zellmembran bevorzugt wird. Diese Regionen bevorzugen möglicherweise nicht die Vereinigung des Proteins.
Je mehr Hämoolis an die Membran binden, desto größer wird die Porenmenge gebildet. Darüber hinaus können Hämoolis miteinander (nebeneinander) oligomerieren und viel größere Kanäle bilden.
Verweise
- Bakás, l., Ostolaza, h., Vaz, w. L., & Goñi, f. M. (neunzehn sechsundneunzig). Reversible Adsorption und nicht reversible Einfügung von Escherichia coli Alpha-Hemolysin in Lipiddoppelschichten. Biophysical Journal, 71 (4), 1869-18766.
- Dalla Serra, m., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,… & Prévot, g. (2005). Staphylococcus aureus bicomponent γ-Hemolysine, HLGA, HLGB und HLGC können zum Zählen aller Komponenten gemischt werden. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, j. ZU., & Robinson, J. (1969). Eigenschaften von gereinigtem Staphylokokken-β-Hämolysin. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike, und., Hashimoto, h., & Clewell, D. B. (1984). Hämolysin von Streptococcus faecalis subpezies Zymogene Sie tragen zur Virulenz bei Mäusen bei. Infektion und Immunität, 45 (2), 528-530.
- Remington, J. S., Klein, j. ENTWEDER., Wilson, c. B., Nizet, v., & Maldonado und. ZU. (Hrsg.). (1976). Infektiöse Wüsten des Fötus und des Neugeborenen (vol. 4). Philadelphia: Saunders.
- Todd, e. W. (1932). Antigene Streptokokken -Hämolysin. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pietrain -Ursprung, Eigenschaften, Lebensmittel, Reproduktion
- Ventile Eigenschaften, Histologie, Funktionen erhalten »

