Hexoquinase -Strukturen, Funktionen, Formen
- 2827
- 265
- Rieke Scheer
Der Hexoquinase (HK) ist das Enzym, das die erste Reaktion des glykolytischen Weges praktisch in allen lebenden Organismen sowohl in Prokaryoten als auch in Eukaryoten katalysiert. Es ist für den Transfer einer Phosphorylgruppe in Richtung Glucose verantwortlich, die Glucose-6p erzeugt, obwohl sie auch andere mittlere hexöse Zucker (von 6 Kohlenstoffatomen) phosphorylieren kann.
Dieses Enzym ist in einer der beiden Familien von Glucose -Kinase -Enzymen (Enzyme, die Phosphorylgruppen über Substrate wie Glucose übertragen) klassifiziert: Die Hexoquinase -Familie (HK), deren Mitglieder in drei verschiedene Gruppen unterteilt sind Gruppe A und Gruppe B.
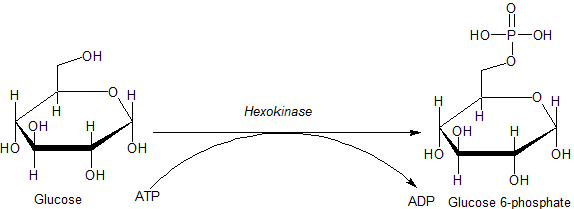
 Reaktion durch das Hexoquinase -Enzym (Quelle: JMUN7616 [Public Domain] über Wikimedia Commons) katalysiert
Reaktion durch das Hexoquinase -Enzym (Quelle: JMUN7616 [Public Domain] über Wikimedia Commons) katalysiert Die zur HK -Familie gehörenden Enzyme sind durch Glucosephosphorylierung auf Kosten von ATP als Phosphorylgruppen -Spendermolekül gekennzeichnet, und die Mitglieder derselben unterscheiden sich hauptsächlich in Bezug auf ihr Molekulargewicht und Substratspezifität voneinander.
Die HK-Gruppe gehört zu den Enzymen eukaryotischer Organismen (ATP: D-Hexose 6-Fosfotransferasen), inzwischen die Gruppe A durch die Enzyme der gramnegativen Bakterien, Cyanobakterien, Amithokonden- und Tripanosomatidenprotisten und Gruppe B enthält die Enzymes der Enzymes der Enzymes der Enzymes der Enzymes der Enzyme -positives Bakterien und Creanarquotas -Organismen.
Die Enzyme der Gruppen A und B werden auch als Glycoquinasen (GLCKs) bezeichnet, da sie in der Lage sind.
Als glykolytisches Enzym hat Hexochinase eine große metabolische Bedeutung, da dieser wichtige Weg nicht möglich wäre und die Zellen, die stark vom Kohlenhydratkonsum abhängen Im Allgemeinen.
[TOC]
Struktur
Wie später zu sehen sein wird, gibt es bei Säugetieren und anderen Wirbeltieren (sowie in einzelligen Organismen wie Hefen) verschiedene Arten von Hexoquinase -Enzymen. Bei Säugetieren wurden vier beschrieben: Isoformen I, II, III und IV.
Kann Ihnen dienen: Eisenlegierungen: Eigenschaften, Typen, BeispieleDie ersten drei Isoenzyme haben 100 kDa -Molekulargewicht, aber das Isoenzym IV hat 50 kDa. Diese Isoenzyme (insbesondere I-III) zeigen eine hohe Sequenzähnlichkeit zwischen ihnen in Bezug auf ihre C- und N-terminalen Zwecke sowie andere Mitglieder der Hexoquinase-Familie.
Die N-terminale Domäne dieser Enzyme gilt als „Regulator“ -Domäne, während die katalytische Aktivität von der C-terminalen Domäne durchgeführt wird (HK II von Säugetieren hat aktive Stellen in beiden Domänen).
Die N-terminale Domäne ist über einen Alpha-Propeller mit der C-terminalen Domäne verbunden, jeweils hat ein Molekulargewicht von etwa 50 kDa und hat eine Verbindung für Glukose.
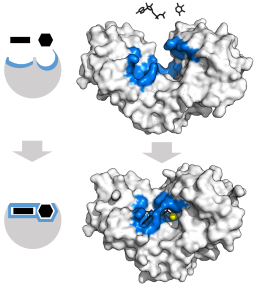 Induziertes Einstellmodell für das Hexoquinase -Enzym (in Bezug auf seine beiden Substrate: ATP und die Glucose) (Quelle: Thomas Shafee [CC um 4).0 (https: // creativecommons.Org/lizenzen/bis/4.0)] über Wikimedia Commons)
Induziertes Einstellmodell für das Hexoquinase -Enzym (in Bezug auf seine beiden Substrate: ATP und die Glucose) (Quelle: Thomas Shafee [CC um 4).0 (https: // creativecommons.Org/lizenzen/bis/4.0)] über Wikimedia Commons) Die tertiäre Struktur dieser Enzyme besteht im Wesentlichen aus β-platzierten Blättern, gemischt mit Alpha-Propellern, deren Anteil in Bezug auf das Enzym und die betreffende Spezies variiert; Die Unionsstelle für das ATP, das andere Hexoquinase -Substrat, besteht normalerweise aus fünf β -Blättern und zwei Alpha -Propellern.
Funktionen
Hexoquinase hat eine transzendentale Funktion im Kohlenhydratmetabolismus der meisten Lebewesen, da der erste Schritt des glykolytischen Weges katalysiert und die Phosphorylierung von Glukose im Inneren vermittelt.
Dieser erste Schritt der Glykolyse, der aus der Übertragung einer Phosphorylgruppe vom ATP (Donor) auf Glucose besteht, die 6-Phosphat- und ADP-Glucose ergibt, ist die erste der beiden Energieinvestitionsstufen in Form von ATP.
Darüber hinaus ist die durch Hexoquinase katalysierte Reaktion der Durchgang der "Aktivierung" von Glucose für die nachfolgende Verarbeitung und stellt einen Schritt der "Engagement" dar, da die Zelle so phosphoryliert ist.
Kann Ihnen dienen: heterogene GemischeDas Produkt der durch Hexoquinase katalysierten Reaktion, dh der 6-Phosphat-Glucose, ist ein Zweigpunkt, da es sich um das erste Substrat handelt die Stärke auf Pflanzen).
In Pflanzen
Die Funktion von Hexoquinase in Pflanzen unterscheidet sich nicht sehr von der von Tieren oder Mikroorganismen. In den oberen Pflanzen fungiert dieses Enzym auch als "Sensor" der Zuckerkonzentration.
Die Bedeutung dieser Funktion in diesen Organismen hat mit der Teilnahme von Zuckern als Regulierungsfaktoren bei der Expression von Genen zu tun, die an verschiedenen Stoffwechselprozessen beteiligt sind, wie z. B.:
- Photosynthese
- Der Glioxylatzyklus
- Die Atmung
- Der Abbau oder die Synthese von Stärke und Saccharose
- Stickstoffstoffwechsel
- Die Verteidigung gegen Krankheitserreger
- Zellzyklusregulation
- Die heilende Reaktion
- Pymentierung
- Seneszenz unter anderem.
Diese Funktion von Hexoquinase als "Sensor" der Menge an intrazellulärer Glukose wurde auch für Hefen und Säugetiere beschrieben.
Formen
In der Natur gibt es verschiedene Formen von Hexoquinasen, und dies hängt grundsätzlich von den Arten ab, die berücksichtigt werden.
Bei Menschen und anderen Wirbeltieren beispielsweise wurde die Existenz von 4 verschiedenen Isoformen des Hexoquinase -Enzyms im zytosolischen Kompartiment nachgewiesen, mit dem es mit den römischen Zahlen I, II, III und IV gekennzeichnet wurde.
Isoenzyme, II und III sind 100 kDa-Molekulargewicht, werden durch ihr Reaktionsprodukt (6-phosphat-Glucose) gehemmt und sind sehr mit Glukose zusammenhängen, dh eine sehr niedrige km konstante. Diese Enzyme haben jedoch eine geringe Spezifität des Substrats, was andere Hexosas wie Fructose und Hand phosphorylieren kann.
Kann Ihnen dienen: Säuren: Eigenschaften und BeispieleDas Isoenzym IV, auch bekannt als Glycoquinase (GLCK), hat nur 50 kDa -Molekulargewicht und hat, obwohl sie wenig verwandt sind (hohe kmwerte Werte), eine hohe Spezifität durch Glukose als Substrat und ist nicht mit ihnen Regulierungsmechanismen unterworfen Drei Isoenzyme.
Glukochinase (Isoenzym IV der Hexoquinase vieler Säugetiere) ist hauptsächlich in der Leber vorhanden und hilft diesem Organ bei der "Anpassung" seiner Glukoseverbrauchsgeschwindigkeit als Reaktion auf die Variationen dieses Substrats im zirkulierenden Blut.
Die drei Gene, die für Hexoquinasen I, II und III bei Tieren kodieren, scheinen nur am C-terminalen Ende zu liegen.
Verweise
- Aronoff, s. L., Berkowitz, k., Shreiner, geb., & Will, l. (2004). Glukosestoffwechsel und -regulation: jenseits von Insulin und Glucagon. Spektrumdiabetes, 17(3), 183-190.
- Harrington, g. N., & Bush, D. R. (2003). Die bifuncionale Rolle der Hexokinase im Stoffwechsel und der Glukosesignalisierung. Die Pflanzenzelle, fünfzehn(11), 2493-2496.
- Jang, j. C., León, p., Zhou, l., & Sheen, j. (1997). Hexokinase als Zuckersensor in höheren Pflanzen. Die Pflanzenzelle, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, geb., & Murata, k. (2005). Hypothese: Strukturen, Evolution und Vorfahren von Glukosekinasen in der Hexokinase -Familie. Journal of Bioscience and Bioengineering, 99(4), 320-330.
- Mathews, k. UND. (1998). Van Holde. Biochemie.
- Wilson, J. UND. (2003). Isozyme der Hexokinase von Säugetieren: Struktur, subzelluläre Lokalisation und Stoffwechselfunktion. Journal of Experimental Biology, 206(12), 2049-2057.
- « 13 Säfte zur Heilung Gastritis (natürlich und wirksam)
- Unterschiedliche Evolution Ursachen und Beispiele »

