Kohlenstoffhybridisierungskonzept, Typen und ihre Eigenschaften
- 1250
- 1
- Medine Kedzierski
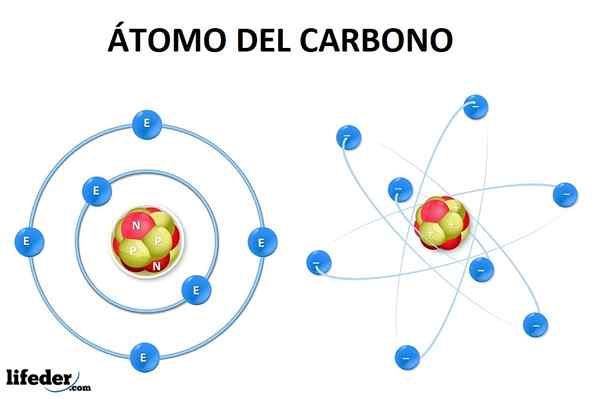
Der Kohlenstoffhybridisierung Es impliziert die Kombination von zwei reinen Atomorbitalen, um ein neues "hybrides" molekulares Orbital mit eigenen Eigenschaften zu bilden. Der Begriff des atomaren Orbitals liefert eine bessere Erklärung als das vorherige Konzept der Umlaufbahn, um eine Annäherung darüber zu ermitteln, wo es wahrscheinlicher ist, dass ein Elektron innerhalb eines Atoms findet.
Mit anderen Worten, ein atomares Orbital ist die Darstellung der Quantenmechanik, um eine Vorstellung von der Position eines Elektrons oder Elektronenpaares in einem bestimmten Bereich innerhalb des Atom Zahlen Quanten.

Quantenzahlen beschreiben den Status eines Systems (z. B. das Elektron im Atom) zu einem bestimmten Zeitpunkt durch Energie, die zum Elektron (n) gehört, dem Winkelimpuls, der in seiner Bewegung (l), dem verwandten magnetischen Moment (m), beschreibt und die Elektron.
Diese Parameter sind für jedes Elektron in einem Orbital eindeutig, sodass zwei Elektronen nicht genau die gleichen Werte der vier Quantenzahlen haben und jedes Orbital in den meisten Elektronen von zwei Elektronen besetzt werden kann.
[TOC]
Was ist Kohlenstoffhybridisierung?
Um die Kohlenstoffhybridisierung zu beschreiben, sollte berücksichtigt werden, dass die Eigenschaften jedes Orbitals (Form, Energie, Größe usw.) hängen von der elektronischen Konfiguration ab, die jedes Atom hat.
Das heißt.
Kann Ihnen dienen: Natrium: Geschichte, Struktur, Eigenschaften, Risiken und VerwendungDie externen Elektronen sind die einzigen, die zur Bildung eines Links zur Verfügung stehen. Wenn daher zwischen zwei Atomen eine chemische Bindung gebildet wird.
Wie oben erwähnt, kann jedes Orbital mit maximal zwei Elektronen gefüllt werden, aber das Aufbau -Prinzip muss nachstehend abtasten:

Auf diese Weise ist die erste Stufe 1 gefülltS, Dann 2S, gefolgt von 2P Und so weiter, je nachdem, wie viele Elektronen das Atom oder Ion hat.
Somit ist Hybridisierung ein Phänomen, das den Molekülen entspricht, da jedes Atom nur reine atomare Orbitale beitragen kann (S, P, D, F) und aufgrund der Kombination von zwei oder mehr atomaren Orbitalen wird die gleiche Menge an hybriden Orbitalen, die die Verbindungen zwischen Elementen ermöglichen, gebildet.
Hybridisierungstypen
Atomarbitale haben unterschiedliche Formen und räumliche Orientierungen, wobei die Komplexität zunimmt, wie unten gezeigt:

Es wird beobachtet, dass es nur eine Art von Orbital gibt S (sphärische Form), drei Arten von Orbital P (lobuläre Form, wobei jeder Lappen auf einer Raumachse ausgerichtet ist), fünf Arten von Orbitaltypen D und sieben Arten von Orbital F, wo jede Art von Orbital genau die gleiche Energie wie die ihrer Klasse hat.
Das Kohlenstoffatom in seinem grundlegenden Zustand hat sechs Elektronen, deren Konfiguration 1 istS22S22P2. Das heißt, sie sollten Level 1 besetzenS (zwei Elektronen), die 2S (zwei Elektronen) und teilweise die 2p (die verbleibenden zwei Elektronen) nach dem Aufbau -Prinzip.
Kann Ihnen dienen: AlotropyDies bedeutet, dass das Kohlenstoffatom nur zwei fehlende Elektronen im Orbital 2 enthältP, Es ist jedoch nicht möglich, die Bildung oder Geometrie des Methanmoleküls zu erklären (CH4) oder andere komplexere.
Um diese Links zu formen, ist die Hybridisierung der Orbitale erforderlich S Und P (Im Falle von Kohlenstoff), um neue Hybridorbitale zu erzeugen, die sogar Doppel- und Dreifachbindungen erklären, bei denen Elektronen die stabilste Konfiguration für die Bildung von Molekülen erhalten.
Sp3
Die Hybridisierung sp3 Es besteht aus der Bildung von vier "Hybrid" -Dorbitalen aus den Orbitalen 2s, 2pX, 2 pUnd und 2pz Rein.
Daher gibt es die Umstrukturierung von Elektronen auf Stufe 2, wo vier Elektronen zur Bildung von vier Bindungen verfügbar sind und parallel so geordnet sind, dass sie weniger Energie haben (größere Stabilität).
Ein Beispiel ist das Ethylenmolekül (C. C2H4), deren Glieder 120 ° Winkel zwischen den Atomen bilden und eine flache trigonale Geometrie liefern.
In diesem Fall werden einfache C-H- und C-C-Links generiert (aufgrund der Orbitale sp2) und eine Doppel-C-C-Bindung (aufgrund des Orbitals P), Um das stabilste Molekül zu bilden.

Sp2
Durch SP -Hybridisierung2 Drei „hybride“ Orbitale werden aus reinem 2S -Orbital erzeugt. Zusätzlich wird ein reines P -Orbital erhalten.
Ein Beispiel ist das Ethylenmolekül (C. C2H4), deren Glieder 120 ° Winkel zwischen den Atomen bilden und eine flache trigonale Geometrie liefern. In diesem Fall werden einfache C-H- und C-C-Links erzeugt (aufgrund von SP-Orbitalen2) und eine doppelte C-C-Bindung (aufgrund von Orbital P), um das stabilste Molekül zu bilden.
Können Ihnen dienen: Chemische Reaktionen: Eigenschaften, Teile, Typen, Beispiele Sp
Sp
Durch SP -Hybridisierung werden zwei „Hybrid“ -Dorbitale aus reinem 2S -Orbital -Orbital hergestellt. Auf diese Weise bilden sie zwei reine Orbitale, die an der Bildung einer dreifachen Verbindung teilnehmen.
Für diese Art von Hybridisierung das Acetylenmolekül (C. C2H2), deren Glieder 180 ° Winkel zwischen den Atomen bilden und eine lineare Geometrie liefern.
Für diese Struktur gibt es einfache C-H- und C-C.

Verweise
- Orbitalhybridisierung. Abgerufen von.Wikipedia.Org
- Fox, m. ZU., Und Whitsell, J. K. (2004). Organische Chemie. Aus Büchern erholt.Google.CO.gehen
- Carey, f. ZU., und Sundberg, r. J. (2000). Fortgeschrittene organische Chemie: Teil A: Struktur und Mechanismen. Aus Büchern erholt.Google.CO.gehen
- Anslyn, e. V., Und Dougherty, D. ZU. (2006). Moderne physikalische organische Chemie. Aus Büchern erholt.Google.CO.gehen
- Mathur, r. B.; Singh, b. P., Und Panda, s. (2016). Kohlenstoffnanomaterialien: Synthese, Struktur, Eigenschaften und Anwendungen. Aus Büchern erholt.Google.CO.gehen
- « Chemische Porositätsmerkmale, Typen und Beispiele
- Morphosyntaktische Merkmale und literarische Ressourcen (Beispiele) »

