Chemische Hybridisierung

- 910
- 149
- Tizian Liebich
Was ist chemische Hybridisierung?
Der Chemische Hybridisierung Es ist die "Mischung" von Atomorbitalen, deren Konzept 1931 vom Chemiker Linus Pauling eingeführt wurde, um die Unvollkommenheiten der Linktheorie von Valencia (TEV) zu behandeln. Welche Unvollkommenheiten? Dies sind: molekulare Geometrien und äquivalente Verbindungen in Molekülen wie Methan (CH4).
Nach dem TEV bilden in Methan die Atomorbitale von C vier σ -Verbindungen mit vier H -Atomen. Die orbitalen 2p mit Formen von ∞ (unteres Bild) des C sind senkrecht zueinander, sodass das H in einem Winkel von 90 ° voneinander entfernt werden sollte.

Zusätzlich das 2s (sphärische) Orbital. Experimentell wurde jedoch festgestellt, dass die Winkel im CH4 Sie sind 109,5 ° und dass die Längen der C-H-Verbindungen zusätzlich gleichwertig sind.
Um dies zu erklären, muss eine Kombination ursprünglicher Atomorbitale als vier degenerierte Hybridorbitale (gleicher Energie) betrachtet werden (gleicher Energie). Hier kommt chemische Hybridisierung ins Spiel. Wie sind Hybridorbitale? Es hängt von den atomaren Orbitalen ab, die sie erzeugen. Sie zeigen auch eine Mischung der elektronischen Eigenschaften dieser.
Sp3
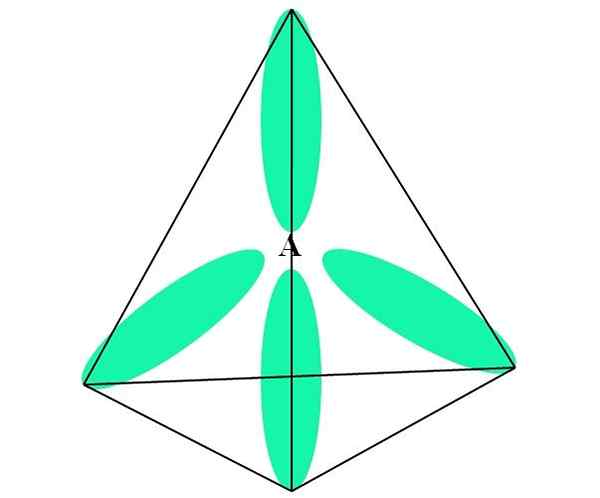
Im Fall von CH4, C Hybridisierung ist sp3. Aus diesem Ansatz wird die molekulare Geometrie mit vier SP -Orbitalen erklärt3 bei 109,5 ° getrennt und auf die Eckpunkte eines Tetraeders zeigen.
Im oberen Bild können Sie sehen, wie die Orbitale sp3 (grün) eine tetraedrische elektronische Umgebung rund um das Atom einrichten (a, das C für CH ist4).
Kann Ihnen dienen: AmineWarum 109,5º und nicht andere Winkel, um eine andere Geometrie zu "zeichnen"? Der Grund ist die Tatsache, dass dieser Winkel die elektronischen Abstoßungen der vier Atome minimiert, die miteinander verbunden sind.
Auf diese Weise Chos Molekül4 Es kann als Tetraeder (tetraedrische molekulare Geometrie) dargestellt werden.
Wenn der C anstelle von H Verbindungen zu anderen Gruppen von Atomen gebildet hat, was würde seine Hybridisierung sein, dann sein? Vorausgesetzt, dass die Kohlenstoff vier Links σ (C-A) bilden, seine Hybridisierung wird SP sein3.
Es kann konsequent angenommen werden, dass in anderen organischen Verbindungen wie CH3Oh, Ccl4, C (Ch3)4, C6H12 (Cyclohexan) usw., Kohlenstoff hat eine SP -Hybridisierung3.
Dies ist wichtig, um organische Strukturen zu skizzieren, bei denen Kohlenstoffe mit einfachen Links Divergenzpunkte darstellen. Das heißt, die Struktur bleibt nicht in einer einzelnen Ebene.
Deutung
Was ist die einfachste Interpretation für diese Hybridorbitale, ohne sich mit mathematischen Aspekten zu befassen (Wellenfunktionen)? Die Orbitale sp3 Sie implizieren, dass sie von vier Orbitalen entstanden sind: eins und drei p.
Weil die Kombination dieser atomaren Orbitale ideal sein soll, die vier SP -Orbitale3 Die resultierenden sind identisch und belegen unterschiedliche Orientierungen im Raum (wie in den Orbitalen pX, PUnd Und Pz).
Die oben genannten gilt für den Rest der möglichen Hybridationen: die Anzahl der gebildeten Hybridorbitale ist die gleiche wie die der atomaren Orbitale, die sich kombinieren. Zum Beispiel sp Híbridos Orbital3D2 Sie stammen aus sechs atomaren Orbitalen: eins, drei p und zwei D.
Abweichungen von Verbindungswinkeln
Nach der Abstoßungstheorie elektronischer Paare der Valencia -Schicht (RPECV) belegen ein Paar freier Elektronen mehr Volumen als ein verknüpftes Atom. Dies führt dazu, dass sich die Verbindungen entfernen, die elektronische Spannung verringern und die Winkel der 109,5º auslenken:
Es kann Ihnen dienen: Cruise for Crucible: Eigenschaften, Funktionen, verwenden Sie Beispiele
Zum Beispiel sind im Wassermolekül die Atome von H mit den Orbitalen SP verbunden3 (in grün) und auch die nicht geteilten Elektronenpaare ":" Besetzen Sie diese Orbitale.
Die Abstoßungen dieser Elektronenpaare werden normalerweise als "zwei Luftballons mit den Augen" dargestellt, die aufgrund ihres Volumens die beiden Glieder σ O-H abweisen.
Im Wasser sind die Gliederwinkel also wirklich 105º anstelle der 109,5º, die für die tetraedrische Geometrie erwartet wird.
Welche Geometrie hat er?2ENTWEDER? Hat eine Winkelgeometrie. Weil? Denn während die elektronische Geometrie tetraedrisch ist.
Sp2
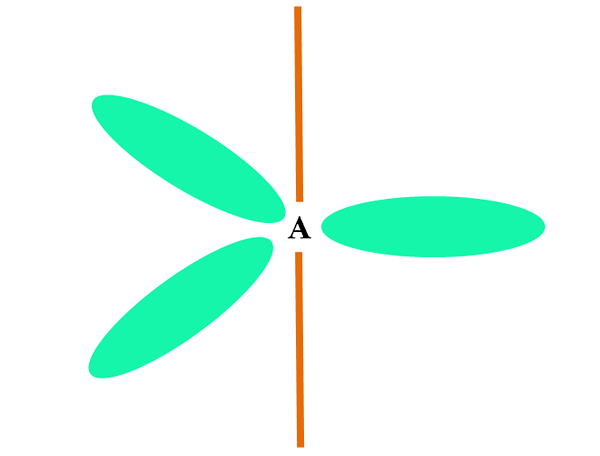
Wenn ein Atom zwei oder S -Orbitale kombiniert, erzeugt es drei hybride Orbitale SP2; Ein Orbital -P (weil es drei gibt) bleibt jedoch unverändert, was als Orangenbalken im oberen Bild dargestellt wird.
Hier die drei Orbitale sp2 Sie sind grün, um ihren Unterschied zum Orangenbalken hervorzuheben: dem Orbital P "rein".
Ein Atom mit SP -Hybridisierung2 Es kann als trigonaler flacher Boden sichtbar gemacht werden (das Dreieck mit den SP -Orbitalen gezeichnet2 grün), mit seinen Eckpunkten durch 120 ° Winkel und senkrecht zu einem Stab.
Und welche Rolle spielt das Orbital Pure Pure Play? Um eine Doppelbindung zu bilden (=). Die Orbitale sp2 Sie ermöglichen die Bildung von drei Links σ, während die Orbitalreine P -Bindung π (eine doppelte oder dreifache Verbindung beinhaltet ein oder zwei Glieder π).
Zum Beispiel, um die Carbonylgruppe und die Struktur des Formaldehydmoleküls (H) zu zeichnen2C = o), es geht wie folgt weiter:
Es kann Ihnen dienen: Cycopropan (C3H6)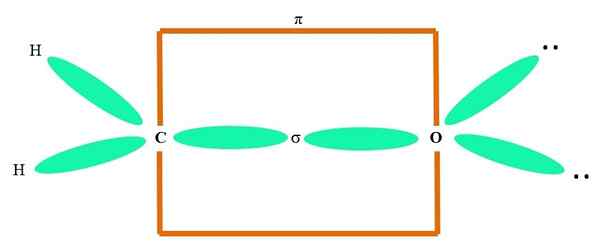
Die Orbitale sp2 Sowohl das C als auch der O bilden ein Glied σ, während seine reinen Orbitale eine π -Bindung bilden (das orange Rechteck).
Es kann bemerkt werden, wie sich der Rest der elektronischen Gruppen (H -Atome und die Paare nicht gemeinsamer Elektronen) in den anderen SP -Orbitalen befinden2, durch 120º getrennt.
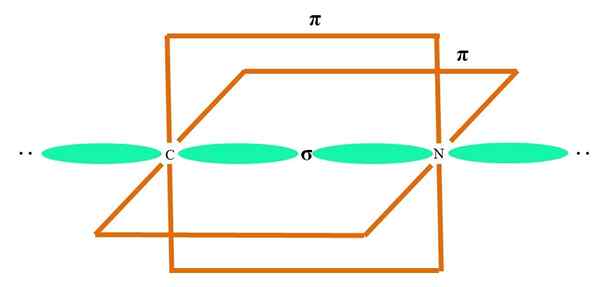
Sp
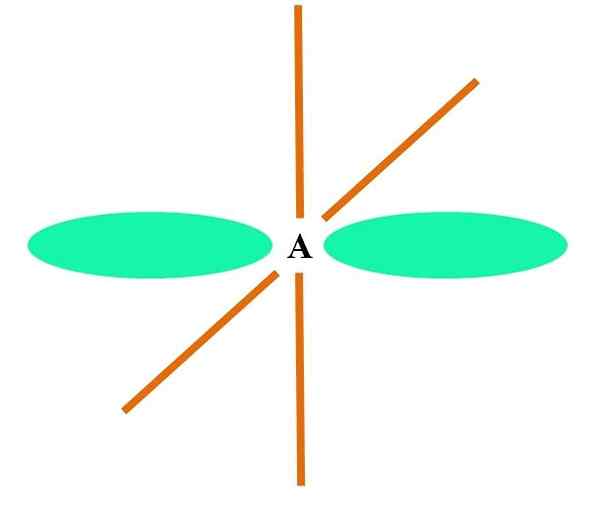
Im überlegenen Bild wird ein Atom mit SP -Hybridisierung veranschaulicht. Hier ein Orbital und ein Orbital p. Zwei reine Orbitalorbitale sind jetzt jedoch unverändert, wodurch sie zwei Doppelverbindungen oder eine dreifache Verbindung bilden können (≡).
Mit anderen Worten: Wenn in einer Struktur A c das obige (= c = o c =C) entspricht, dann ist seine Hybridisierung SP. Für andere weniger veranschaulichende Atome - wie Übergangsmetalle - ist die Beschreibung der elektronischen und molekularen Geometrien kompliziert, da die Orbitale d und sogar die F berücksichtigt werden.
Hybridorbitale sind in einem Winkel von 180 ° getrennt. Aus diesem Grund sind die verknüpften Atome in einer linearen molekularen Geometrie (B-A-B) angeordnet. Schließlich ist im unteren Bild die Cyanid -Anionenstruktur zu sehen: