Hydrazinstruktur, Eigenschaften, Synthese, verwendet

- 4902
- 1261
- Joy Hort
Der Hydrazin Es ist eine anorganische Verbindung, deren chemische Formel n ist2H4. Es besteht aus einem Mitglied der Familie der Stickstoffhydrors. Obwohl sein Molekül Einfachheit erscheint, weist es mehrere chemische und physikalische Eigenschaften auf, die Hydrazin zu einer interessanten und energetisch vielversprechenden Substanz machen.
Halten Sie eine enge Ähnlichkeit mit Wasser, da beide als flüssige Substanzen in ähnlichen Temperaturen Intervallen existieren. Aus Hydrazin können wir organische Derivate erhalten, indem wir seine Hydrogene durch kohlensäurehaltige Gruppen ersetzen. Auch von IT synthetisierten Hydrazons, Hydrazide und Hydrazinsalze.
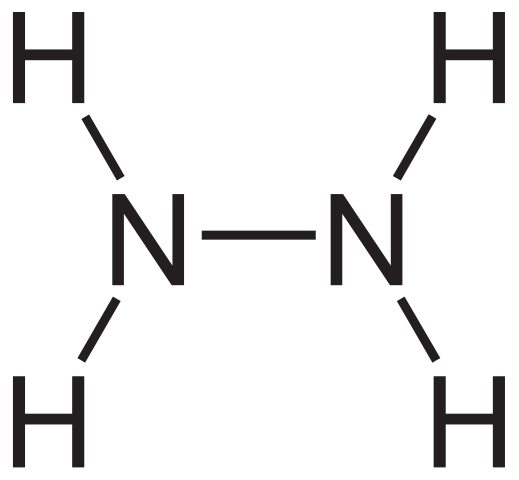 Hydrazinstrukturformel. Quelle: Neurotoger über Wikipedia.
Hydrazinstrukturformel. Quelle: Neurotoger über Wikipedia. Die strukturelle Formel von Hydrazin ist oben zu sehen, die als h geschrieben werden kann2Nnh2 oder h2N-nh2. Wenn Sie genau hinschauen, scheint es, dass zwei NH -Moleküle3 Sie hätten miteinander verbunden. Bei der Bildung der N-N-Verbindung nicht nur Ammoniakmoleküle, da Reagenzien beteiligt sind.
Hydrazin ist eine Verbindung mit mehreren Anwendungen, da sie ein ausgezeichneter Vorläufer für Symphine von Verbindungen ist, sowohl organisch als auch anorganisch. Ebenso ist es dank seiner reduzierenden Kraft und seiner Zersetzungsprodukte dazu bestimmt, Sauerstoff und andere Gase zu beseitigen, Edelmetalle zu erhalten. Und vor allem, um Raumschiffe und Staat zu fördern, das A -Karton -Flugzeug.
[TOC]
Hydracinstruktur
Molekül und Link
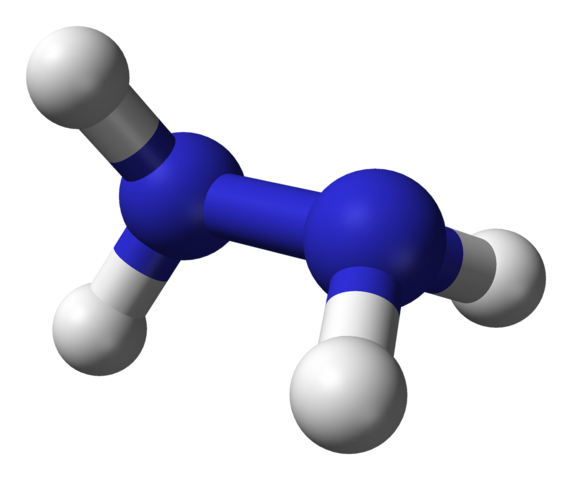 Molekülstruktur von Hydrazin. Quelle: Ben Mills über Wikipedia.
Molekülstruktur von Hydrazin. Quelle: Ben Mills über Wikipedia. Im oberen Bild haben wir das Hydrazinmolekül, das durch ein Kugeln und Balkenmodell dargestellt wird. Beachten Sie, dass die räumliche Ausrichtung von Wasserstoffatomen, weiße Kugeln, mit dem Eindruck der Strukturformel kontrastiert; Das heißt2 Sie sind nicht ausgerichtet oder in den Schattenstermeter, sondern haben einen Drehwinkel von 95 ° miteinander.
Tatsächlich ist es so sehr, dass die N-N-Verbindung kaum in der Lage ist, sich zu drehen, und eine Energiebarriere, die abgelaufen werden muss, um die vier Wasserstoffatome zu vertuschen.
Um was geht es hierbei? Grundsätzlich zu starken elektronischen Abstoßungen, bei denen sich die beiden Paare von Einzelelektronen auf Stickstoffatomen gegenseitig verzeichnen. Dieser 95º -Winkel ist derjenige, der dem Hydrazinmolekül die größte Stabilität verleiht.
Kann Ihnen dienen: Lithiumbromid: Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenGeometrien
Jedes Stickstoffatom hat eine SP -Hybridisierung3, Annahme einer dreieckigen Pyramidengeometrie. Daher konnte bei den freien Elektronenpaaren das Hydracin -Molekül wie zwei Pyramiden, die von einem seiner Eckpunkte verbunden sind.
Intermolekulare Wechselwirkungen
Die Formel h2Nnh2 Ich könnte die falsche Idee geben, dass Hydrazin eine apolare Verbindung ist, die zwei gleiche Gruppen miteinander verbunden ist. Die molekulare Struktur und ihre gedrehte N-N-Bindung zeigen jedoch, dass das Molekül nicht vollständig symmetrisch ist, und auch erwähnt, dass ihre freien Elektronenpaare nicht in entgegengesetzte Richtungen zeigen.
Dies bedeutet, dass Hydrazin, das strukturell und elektronisch asymmetrisch ist, ein Dipolmoment darstellt. Und daher interagieren ihre Moleküle durch Dipol-Dipol miteinander2Nnh2-NH2NH2, die für Hydrazin verantwortlich sind, die einen sehr hohen Siedepunkt haben.
Hydracineigenschaften
 Hydrazinhydrat. Quelle: lhchem/cc By-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)
Hydrazinhydrat. Quelle: lhchem/cc By-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0) Aussehen
Hydrazin ist eine farblose Flüssigkeit, die Wasser ähnlich wie Viskosität und Dichte ähnelt. Beim Brennen emitiert weiße Dämpfe, zusätzlich zu Ammoniak und Fisch.
Molmasse
32.0452 g/mol
Schmelzpunkt
2 ºC.
Siedepunkt
114 ºC. Es ist zu beachten.
Dichte
1.021 g/cm3
Dampfdichte
1.1 in der Luftbeziehung.
Dampfdruck
Ungefähr 0.010 atm bei 30.7 ºC
Löslichkeit
Hydrazin ist sowohl mit Wasser als auch mit mehreren primären Alkoholen mischbar. Hydrazin bildet ein Hydrat mit Wasser, n2H4· H2Oder, was durch dichter als reiner oder wasserfreier Hydrazin gekennzeichnet ist. Dieses Hydrat ist das am meisten vermarktete Produkt, da es stabiler und billiger ist.
Dipolarem Moment
1.85 d. Es ist eine eher polare Substanz, fast der gleiche wie Wasser.
Es kann Ihnen dienen: Yodiumsäure (HIO3): Struktur, Eigenschaften, Risiken und VerwendungSchmiere
0.876 CP
Flammpunkt
52 ºC
Selbstdirektionstemperatur
Variiert je nach Substanzen oder Oberflächen, mit denen es in Kontakt kommt. Zum Beispiel brennt auf Eisenoxiden bei 23 ° C, während es auf Glas oder anderen Behältern erst 270 ° C entzündet wird.
Zersetzung
Wenn es in der Luft brennt, zersetzt es sich in Stickoxiden, neinX. In Bezug auf seine katalytische Zersetzung, dh durch Metalloxide oder Metall beschleunigt.
Reaktivität
Hydrazin ist ein gutes Reduktionsmittel, da bei oxidiertem Wasser Wasser und Stickstoff erzeugt, beide Verbindungen, die keine sekundären Reaktionen erleiden.
Andererseits ist Hydrazin ein Nucleophil, da es seine freien Elektronenpaare verwendet, um sich anderen organischen Molekülen anzuschließen. Ebenso kann es ersetzen leiden3, Methylierte Derivate produzieren: CH3NHNH2 oder (ch3)2Nnh2.
Reagiert mit starken Säuren, um Hidrazinio -Salze, N2H5X und aus Hidrazonio, n2H6X2. Letztere sind am wenigsten häufig. Hydraziniumsulfat, [N)2H5] HSO4, Es wird hergestellt, indem Hydrazinhydrat mit Schwefelsäure reagiert wird.
Basizität
Hydrazin ist eine schwächere Basis als Ammoniak:
N2H4(Ac) + h2Oder (l) ⇌ n2H5+(Ac) + oh-(Ac)
KB = 1.3 · 10-6
Dies liegt daran, dass Hydrazinio -Konjugat -Säure2H5+ oder h3N+-NH2, Hat seine Last durch den Attraktoreffekt der NH -Gruppe destabilisiert2; Das heißt, anstatt dem positiven Stickstoff eine elektronische Dichte zu verleihen, ist der Entzug.
Hydrazin kann eine zweite, viel weniger wahrscheinliche Protonierung leiden, die eine noch instabilere konjugierte Säure erzeugt:
N2H5+(Ac) + h2Oder (l) ⇌ n2H6+(Ac) + oh-(Ac)
KB = 8.4 · 10-16
Das Hydrazonium, n2H6+ oder h3N+-N+H3, Es ist aufgrund der Abstoßungen zwischen den positiven Lasten beider Stickstoffatome sehr instabil. In der Gesellschaft bestimmter Anionen kann es jedoch als Salz existieren.
Toxizität
Anhydra Hydrazin ist eine extrem giftige, ätzende und möglicherweise krebserregende Substanz, ganz zu schweigen davon, dass sie sehr explosiv ist. Daher sollte es nur unter strengen Sicherheitsprotokollen manipuliert werden.
Kann Ihnen dienen: Kompressibilitätsfaktor: Berechnung, Beispiele und ÜbungenSynthese
Die am häufigsten verwendete Methode zur Synthese von Hydrazin ist der Raschig -Prozess. Dies besteht aus den folgenden zwei Reaktionen:
NH3(AC) + Naocl (AC) → NH2Cl (AC) + NaOH (AC)
2nh3(Ac) + nh2Cl (ac) → n2H4(Ac) + nh4Cl (AC)
Am Ende wird das Hydrat n gebildet2H4· H2Oder, das in Gegenwart von Koh oder Naoh als trockene Feststoffe destilliert wird:
N2H4· H2O → n2H4
Auf diese Weise wird das Anhydra-Hydrazin erhalten und die N-N-Verbindung wird gebildet.
Hydrazin verwendet
 Hydrazin ist eine der am meisten geschätzten Substanzen im Luft- und Raumfahrtboom. Quelle: pxhere.
Hydrazin ist eine der am meisten geschätzten Substanzen im Luft- und Raumfahrtboom. Quelle: pxhere. - Hydrazin in Gegenwart von metallischen Katalysatoren wird extermisch abgebaut, um Stickstoff und Wasserstoff zu produzieren, wodurch genügend Energie gewährt wird, um Flugzeuge, Raketen und Satelliten zu steigern.
- Diese Tendenz, Gase zu brechen und zu verursachen.
- Ebenso können diese durch Freisetzung von Gasen andere ziehen, die in Rohren aus den Rohren gelöst sind. Daher ist es sehr nützlich, Sauerstoff aus Kesseln zu beseitigen und so zu vermeiden, dass sie korrodieren.
- Hydrazin ist ein Vorläufermaterial für viele organische Verbindungen mit pharmakologischen Funktionen, Antimungiziden, Herbiziden, Insektiziden, Düngemitteln usw. Dies liegt darin, dass eine Vielzahl von zyklischen Stickstoffderivaten synthetisiert wird.
- Schließlich werden Hydrazin und seine Hydraziniumsalze ein gutes Reduktionsmittel sind, um Edelmetallmineralien zu reduzieren, was in der metallurgischen Industrie von großem Wert ist.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Hydrazin. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Hydrazin. Pubchem Comunund -Zusammenfassung für CID 9321. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Die Herausgeber von Enyclopaedia Britannica. (2020). Hydrazin. Britannica Encyclopaedia. Erholt von: Britannica.com
- Iridium als nächstes. (20. Juni 2017). Hydrazin - giftig für Menschen, aber Satelliten lieben es. Erholt von: Iridium.com
- « Die 95 besten Sätze von The Walking Dead
- Unabhängigkeit des Beckens Ursachen, Entwicklung, Konsequenzen »

