Wasserstoffgeschichte, Struktur, Eigenschaften und Verwendung

- 1723
- 386
- Ibrahim Steuk
Er Wasserstoff Es ist ein chemisches Element, das durch Symbol H dargestellt wird. Sein Atom ist das kleinste von allen und es beginnt der Periodensystem, unabhängig davon, wo er positioniert ist. Es besteht aus einem farblosen Gas, das aus Diatommolekülen von H besteht2, und nicht für isolierte Atome von H; Wie bei den edlen Gasen, NE, AR unter anderem.
Von allen Elementen ist es vielleicht das emblematischste und hervorgehobene Element. Wasserstoff ist ein Gas, wenn auch in Abwesenheit von Feuer, brennbar und gefährlich; Während Wasser, h2Oder es ist das universelle Lösungsmittel und Leben.
 Rote Zylinder zum Speichern von Wasserstoff. Quelle: Famartin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Rote Zylinder zum Speichern von Wasserstoff. Quelle: Famartin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Wasserstoff zeigt keine visuelle Besonderheit, die es wert ist, bewundert zu werden, einfach ein Gas, das in roten Zylindern oder Hubs gespeichert ist. Sie sind jedoch seine Eigenschaften und ihre Fähigkeit, sich mit allen Elementen zu verbinden, die zu speziellen Wasserstoff zurückkehren. Und all das, obwohl es nur ein Elektron von Valencia hat.
Wenn der Wasserstoff nicht in ihren jeweiligen Zylindern gespeichert ist, würde er dem Raum entkommen, während ein großer Teil im Aufstieg reagiert. Und selbst wenn es eine sehr geringe Konzentration in der Luft hat, die wir atmen, außerhalb der Erde und im Rest des Universums, ist es das am häufigsten vorkommende Element, das in den Sternen ist und seine Baueinheit betrachtet hat.
Auf der Erde dagegen entspricht es etwa 10% seiner Gesamtmasse. Um sich vorzustellen, was dies bedeutet, sollte berücksichtigt werden, dass die Oberfläche des Planeten praktisch mit Ozeanen bedeckt ist und dass Wasserstoff in Mineralien, in Ölöl und in jeder organischen Verbindung vorkommt und nicht nur Teil aller Lebewesen ist.
Wie Kohlenstoff, alle Biomoleküle (Kohlenhydrate, Proteine, Enzyme, DNA usw.) Sie haben Wasserstoffatome. Daher gibt es viele Quellen, die sie extrahieren oder produzieren können; Nur wenige repräsentieren jedoch wirklich profitable Produktionsmethoden.
[TOC]
Geschichte
Identifizierung und Name
Obwohl Robert Boyle 1671 zum ersten Mal ein Gas miterlebte, das gebildet wurde, als Eisenakten mit Säuren reagierten, war der britische Wissenschaftler Henry Cavendish 1766, der ihn als neue Substanz identifizierte; Die "entzündbare Luft".
Cavendish stellte fest, dass beim Brennen dieser angeblichen brennbaren Luft Wasser erzeugt wurde. Basierend auf seinen Arbeiten und Ergebnissen gab der französische Chemiker Antoine Lavoizier diesem Gas 1783 den Namen Wasserstoff. Etymologisch stammt seine Bedeutung aus den griechischen Wörtern "Hydro" und "Gene": Wasserformator.
Elektrolyse und Kraftstoff
Kurz darauf stellten amerikanische Wissenschaftler William Nicholson und Sir Anthony Carlisle fest, dass sich Wasser in Wasserstoff und Sauerstoff zerlegen kann; hatte Wasserelektrolyse gefunden. Anschließend führte der Schweizer Chemiker Christian Friedrich Schönbein die Idee ein, die Wasserstoffverbrennung zu nutzen, um Strom zu erzeugen.
Die Popularität von Wasserstoff war so sehr, dass selbst der Schriftsteller Julio Verne es als Kraftstoff der Zukunft in seinem Buch bezeichnete Die mysteriöse Insel (1874).
Isolation
Im Jahr 1899 war der schottische Chemiker James Dewar der erste, der Wasserstoff als Flüssiggas isolierte, der es selbst war, der es genug kühlen konnte, um es in seiner festen Phase zu erhalten.
Zwei Kanäle
Ab diesem Zeitpunkt präsentiert die Geschichte von Wasserstoff zwei Kanäle. Einerseits seine Entwicklung auf dem Gebiet der Kraftstoffe und Batterien; Und andererseits das Verständnis der Struktur seines Atoms und wie er das Element darstellte, das die Türen für die Quantenphysik öffnete.
Elektronische Struktur und Konfiguration
 Diatomisches Wasserstoffmolekül. Quelle: Benjah-BMM27 [Public Domain]
Diatomisches Wasserstoffmolekül. Quelle: Benjah-BMM27 [Public Domain] Wasserstoffatome sind sehr klein und haben kaum ein Elektron, um kovalente Bindungen zu bilden. Wenn zwei dieser Atome zusammenkommen, führen sie zu einem diatomischen Molekül, H2; Dies ist Gasmolekularwasserstoff (überlegenes Bild). Jede weiße Kugel entspricht einem einzelnen H -Atom und der globalen Sphäre zu molekularen Orbitalen.
So besteht Wasserstoff wirklich aus H -Molekülen2 Sehr klein, die durch Londoner Dispersionskräfte interagieren, da ihnen ein Dipolmoment fehlt, weil sie homonukleär sind. Daher sind sie sehr "unruhig" und verbreiten sich im Weltraum schnell, da es keine starken intermolekularen Kräfte gibt, um sie zu verlangsamen.
Die elektronische Wasserstoffkonfiguration beträgt einfach 1s1. Dieses Orbital 1S ist das Produkt der Auflösung der berühmten Schrödinger -Gleichung für das Wasserstoffatom. In h2 Zwei 1S -Orbitale überlappen sich zu zwei molekularen Orbitalen: einer von Link und einem anderen von Antienlace gemäß der molekularen Orbitalentheorie (TOM).
Diese Orbitale erlauben oder erklären die Existenz von H -Ionen2+ oder h2-; Die Wasserstoffchemie wird jedoch unter normalen Bedingungen durch H definiert2 oder die Ionen h+ oder h-.
Oxidationszahlen
Aus der elektronischen Konfiguration für Wasserstoff 1s1, Es ist sehr einfach, seine möglichen Oxidationszahlen vorherzusagen. Natürlich ist das Orbital 2s größerer Energie im Verständnis für chemische Verbindungen nicht verfügbar. Somit hat der Wasserstoff im basalen Zustand eine Oxidationszahl von 0, h0.
Es kann Ihnen dienen: Nickelhydroxid (ii): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenWenn Sie Ihr einziges Elektron verlieren, ist das 1S -Orbital leer und das Kation oder das Wasserstoffionen gebildet, h+, von großer Mobilität in fast jedem flüssigen Medium; Besonders Wasser. In diesem Fall beträgt die Oxidationszahl +1.
Und wenn das Gegenteil passiert, das heißt, ein Elektron zu gewinnen, hat das Orbital jetzt zwei Elektronen und ist 1s2. Dann beträgt die Oxidationszahl -1 und entspricht dem Hydrid -Anion, H-. Es ist erwähnenswert, dass h- Er ist isolektronisch von edlem Heliumgas, er; Das heißt, beide Arten haben die gleiche Anzahl von Elektronen.
Zusammenfassend sind die Wasserstoffoxidationszahlen: +1, 0 und -1 und das H -Molekül2 zählt, als hätten sie zwei Wasserstoffatome H0.
Phasen
Die Lieblingsphase von Wasserstoff, zumindest unter terrestrischen Bedingungen, ist Soda aus den zuvor angegebenen Gründen. Wenn jedoch die Temperatur in der Größenordnung von -200 ° C abnimmt oder wenn der Druck hunderttausende Male als atmosphärisch ansteigt, kann Wasserstoff in einer flüssigen bzw. festen Phase kondensieren oder kristallisieren.
Unter diesen Bedingungen die Moleküle H2 Sie können sich mit verschiedenen Möglichkeiten übereinstimmen, um Strukturmuster zu definieren. Die Londoner Dispersionskräfte werden jetzt zu stark richtungsfähig und daher erscheinen Geometrien oder Symmetrien, die von Gleichaltrigen angewendet werden2.
Zum Beispiel zwei Hsses h2, Es ist wie beim Schreiben (h2)2 Definieren Sie ein symmetrisches oder asymmetrisches Quadrat. Inzwischen drei Paare h2, oder (h2)3 Sie definieren einen Sechseck, der denen von Kohlenstoff in Graphitkristallen sehr ähnlich ist. Tatsächlich ist diese hexagonale Phase die Haupt- oder am stabilste für festen Wasserstoff.
Aber was wäre, wenn der Feststoff nicht aus Molekülen, sondern aus H besteht? Dann würden wir uns mit metallischem Wasserstoff befassen. Diese H -Atome, die sich an die weißen Kugeln erinnern, können sowohl eine flüssige Phase als auch einen metallischen Feststoff definieren.
Eigenschaften
Aussehen
Wasserstoff ist ein farbloses, geruchlosem und geschmackloser Gas. Wenn ein Leck vorhanden ist, ist ein Explosionsrisiko.
Siedepunkt
-253 ºC.
Schmelzpunkt
-259 ºC.
Zündungspunkt und Stabilität
Praktisch explodiert es bei jeder Temperatur, wenn es in der Nähe von Gas eine Funke oder eine Wärmequelle gibt, selbst Sonnenlicht kann Wasserstoff abfeuern. Solange es gut gespeichert ist, ist es ein wenig reaktives Gas.
Dichte
0,082 g/l. Ist 14 -mal leichter als Luft.
Löslichkeit
1,62 mg/l bei 21 ºC in Wasser. Im Allgemeinen ist es in den meisten Flüssigkeiten unlöslich.
Dampfdruck
1,24 · 106 mmHg bei 25 ° C. Dieser Wert gibt eine Vorstellung davon, wie geschlossen die Wasserstoffzylinder sein müssen, um zu verhindern, dass Gas entkommt.
Selbstdirektionstemperatur
560 VºC.
Elektronegativität
2.20 auf der Paulingskala.
Verbrennungswärme
-285.8 kJ/mol.
Verdampfungswärme
0,90 kJ/mol.
Fusionshitze
0,117 kJ/mol.
Isotope
Das "normale" Wasserstoffatom ist der Protio, 1H, das rund 99,985% Wasserstoff ausmacht. Die anderen beiden Isotope für dieses Element sind das Deuterium, 2H und das Tritium, 3H. Diese unterscheiden sich in der Anzahl der Neutronen; Das Deuterium hat ein Neutron, während das Tritio zwei hat.
Stacheln Isomere
Es gibt zwei Arten von molekularen Wasserstoff, H2: Ortho und für. In den ersten Spins (des Protons) der H -Atome sind die beiden Spins (des Protons) der H -Atome in derselben Richtung ausgerichtet (sie sind parallel); Während im zweiten sind die beiden Spins in entgegengesetzte Richtungen (sie sind antiparallel).
Wasserstoff für das stabilste der beiden Isomere; Aber durch Erhöhen der Temperatur die ortho-Beziehung: 3: 1 werden, was bedeutet, dass das Wasserstofforgan-Isomer über den anderen vorherrscht. Bei sehr niedrigen Temperaturen (fernnah an absoluter Null, 20k), reiner Wasserstoff für.
Nomenklatur
Die Nomenklatur, die sich auf Wasserstoff bezieht, ist eine der einfachsten; Obwohl es nicht die gleiche Art für ihre anorganischen oder organischen Verbindungen ist. Die h2 Es kann neben 'Wasserstoff' mit den folgenden Namen aufgerufen werden:
-Molekularer Wasserstoff
-Dihydrogen
-Diatomisches Wasserstoffmolekül.
Für Ion h+ Ihre Namen sind Protonen oder Wasserstoffionen; Und wenn es in wässrigem Medium ist, h3ENTWEDER+, Hydroniumkation. Während Ion h- Es ist der Hydridanion.
Das Wasserstoffatom
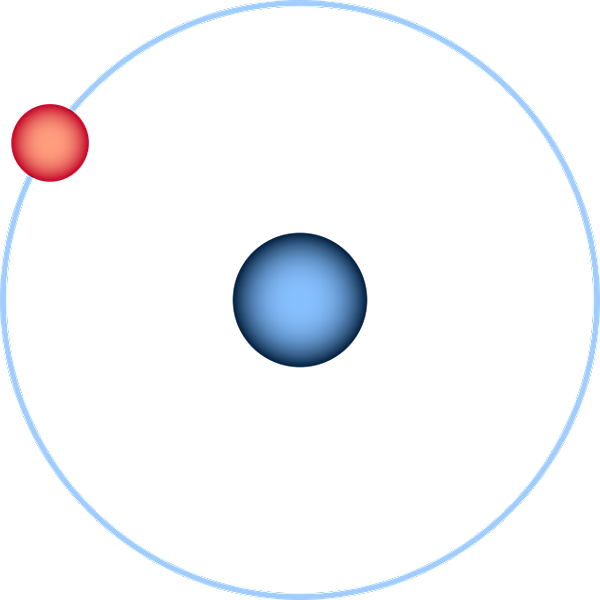 Das Wasserstoffatom, das durch das planetarische Modell von Bohr dargestellt wird. Quelle: Pixabay.
Das Wasserstoffatom, das durch das planetarische Modell von Bohr dargestellt wird. Quelle: Pixabay. Das Wasserstoffatom ist das einfachste von allen und wird normalerweise wie im überlegenen Bild dargestellt: ein Kern mit einem einsamen Proton (für die 1H), umgeben von einem Elektron, das eine Umlaufbahn zieht. In diesem Atom wurden alle Atomorbitale für die anderen Elemente der Periodenzüchter aufgebaut und geschätzt.
Eine loyalere Darstellung des aktuellen Verständnisses von Atomen wäre die einer Sphäre, deren Peripherie durch die elektronische und probabilistische Wolke des Elektrons definiert wird (sein 1S -Orbital).
Kann Ihnen dienen: Thermal: Struktur, Eigenschaften, Bildung, BeispieleWo ist und Produktion
 Ein Sternenfeld: unerschöpfliche Wasserstoffquelle. Quelle: Pixabay.
Ein Sternenfeld: unerschöpfliche Wasserstoffquelle. Quelle: Pixabay. Wasserstoff ist, wenn auch möglicherweise in geringerem Maße im Vergleich zu Kohlenstoff, das chemische Element, das ohne Zweifel überall gesagt werden kann. In der Luft, zusätzlich zum Wasser, das die Meere, Ozeane und unseren Körper, in Ölrohn und Mineralien sowie in den organischen Verbindungen, die zusammengestellt werden.
Es reicht aus, jeden zusammengesetzten Buchladen oberflächlich zu betrachten, um Wasserstoffatome darin zu finden.
Die Frage liegt nicht so sehr, wie viel, sondern wie es präsent ist. Zum Beispiel das M -Molekül2 Es ist so volatil und reaktiv unter der Inzidenz von Sonnenstrahlen, was in der Atmosphäre sehr knapp ist; Daher reagiert es auf andere Elemente und somit somit Stabilität.
Während oben, im Kosmos, ist Wasserstoff überwiegend als neutrale Atome, h.
Tatsächlich wird Wasserstoff in seiner Metall- und Kondensationsphase wie der Sternkonstruktionseinheit betrachtet. Wenn es unermessliche Mengen von ihnen gibt und aufgrund ihrer Robustheit und kolossalen Dimensionen dieses Element zum häufigsten des gesamten Universums machen. Es wird geschätzt, dass 75% der bekannten Materie Wasserstoffatomen entsprechen.
Natürlich
Sammeln Sie die Atome von losen Wasserstoffen im Weltraum -Geräuschen unverändert und extrahieren Sie sie aus den Peripherien der Sonne oder des nebulösen, unerreichbaren. Auf Erden, wo seine Bedingungen dieses Element dazu zwingen, als h zu existieren2, Es kann durch natürliche oder geologische Prozesse auftreten.
Zum Beispiel hat Wasserstoff einen eigenen natürlichen Zyklus, in dem bestimmte Bakterien, Mikroben und Algen ihn durch photochemische Reaktionen erzeugen können. Die Eskalation natürlicher Prozesse und Parallelen dazu umfasst die Verwendung von Bioreaktoren.
Lebewesen sind auch Wasserstoffhersteller, aber in geringerem Maße. In diesem Fall konnte nicht erklärt werden, wie eine der gasförmigen Komponenten von Blähungen ausmacht; die übermäßig gezeigt haben, dass sie brennbar sind.
Schließlich ist erwähnenswert, dass Mineralien bei beispielsweise in unterirdischen Schichten beispielsweise bei anaeroben Bedingungen (ohne Sauerstoff) langsam mit Wasser reagieren können, um Wasserstoff zu produzieren. Fayelitas Reaktion zeigt es:
3FE2Siio4 + 2 h2O → 2 Glaube3ENTWEDER4 + 3 Siio2 + 3 h2
Industriell
Während Biohydrogen eine Alternative zur Erzeugung dieses Gases auf industriellen Maßstäben ist, müssen die am häufigsten verwendeten Methoden praktisch "Wasserstoff zu den Verbindungen, die es enthalten2.
Die geringsten Umweltmethoden zur Herstellung bestehen darin, die Koks (oder Holzkohle) mit überhitztem Wasserdampf zu reagieren:
C (s) + h2O (g) → co (g) + h2(G)
Ebenso wurde Erdgas für diesen Zweck verwendet:
CH4(g) + h2O (g) → Co (g) + 3h2(G)
Und weil die Mengen an Koks oder Erdgas groß sind, ist es rentabel, durch eine dieser beiden Reaktionen Wasserstoff zu produzieren.
Eine andere Methode, um Wasserstoff zu erhalten, besteht darin, einen elektrischen Schock auf das Wasser anzuwenden, um ihn in seinen Elementarteilen (Elektrolyse) zu zersetzen:
2 h2Oder (l) → 2 h2(g) + oder2(G)
Im Labor
In jedem Labor kann molekularer Wasserstoff in kleinen Mengen hergestellt werden. Dazu sollte ein aktives Metall mit einer starken Säure in einem Becherer oder in einem Reagenzglas reagiert werden. Die beobachtbare Blase ist ein klares Zeichen der Wasserstoffbildung, dargestellt durch die folgende allgemeine Gleichung:
M (s) + nh+(Ac) → mN+(Ac) + h2(G)
Wo n ist die Metallvalencia. Somit reagiert Magnesium beispielsweise mit H+ H2:
Mg (s) + 2h+(Ac) → mg2+(Ac) + h2(G)
Reaktionen
Rédox
Oxidationszahlen selbst bieten einen ersten Ansatz dafür, wie Wasserstoff an chemischen Reaktionen beteiligt ist. Die h2 Bei der Reaktion kann es unverändert bleiben oder sich auf die H -Ionen teilen+ oder h- Je nachdem, welche Art es verbindet; Wenn sie mehr oder weniger elektronegativ sind als er.
Die h2 Es ist aufgrund der Stärke seiner kovalenten Bindung H-H wenig reaktiv; Dies ist jedoch kein absoluter Hindernis, um Verbindungen mit fast allen Elementen der Periodenzüchter zu reagieren und zu bilden.
Die bekannteste Reaktion ist die von Sauerstoffgas, um Wasserdämpfe zu erzeugen:
H2(g) + oder2(g) → 2H2O (g)
Und es ist eine solche Affinität für Sauerstoff, um das stabile Wassermolekül zu bilden, das sogar als Anion mit ihm reagieren kann oder2- In bestimmten Metalloxiden:
H2(g) + cuo (s) → cu (s) + h2Oder (l)
Auch Silberoxid reagiert oder reduziert "durch die gleiche Reaktion:
H2(g) + Aug (s) → Ag (s) + h2Oder (l)
Diese Wasserstoffreaktionen entsprechen denen des Rédox -Typs. Das heißt, Reduktionsoxidation. Wasserstoff oxidiert sowohl in Gegenwart von Sauerstoff als auch Metalloxiden weniger reaktiven Metallen als er; Zum Beispiel Kupfer, Silber, Wolfram, Quecksilber und Gold.
Absorption
Einige Metalle können gasförmige Wasserstoff zur Bildung von Metallhydrors absorbieren, die als Legierungen angesehen werden. Zum Beispiel nehmen Übergangsmetalle wie Paladium berüchtigte Mengen von H ab2, ähnlich wie Metallschwämme.
Kann Ihnen dienen: Neodymium: Struktur, Eigenschaften, verwendetDas gleiche passiert mit komplexeren Metalllegierungen. Auf diese Weise kann Wasserstoff zusätzlich zu seinen Zylindern auf andere Weise gespeichert werden.
Zusatz
Organische Moleküle können auch Wasserstoff durch molekulare Mechanismen und/oder unterschiedliche Wechselwirkungen "absorbieren".
Für Metalle, H -Moleküle2 Sie sind von Metallatomen in ihren Kristallen umgeben; Während in organischen Molekülen wird die H-H-Bindung gebrochen, um andere kovalente Bindungen zu bilden. In einem formalisierteren Sinne: Wasserstoff wird nicht absorbiert, sondern zur Struktur hinzugefügt.
Das klassische Beispiel ist die Zugabe von H2 Doppel- oder dreifache Verbindung von Alkenen bzw. Alkinen:
C = C + H2 → H-C-C-H
C≡C + H2 → hc = ch
Diese Reaktionen erhalten auch den Namen der Hydrierung.
Hydros -Bildung
Wasserstoff reagiert direkt auf die Elemente, um eine Familie chemischer Verbindungen zu bilden, die als Hydros bezeichnet werden. Es gibt hauptsächlich zwei Arten: Salinos und Molekular.
Es gibt auch Metallhydrors, die aus den bereits erwähnten Metalllegierungen bestehen, wenn diese Metalle gasförmige Wasserstoff absorbieren. und das Polymer mit Netzwerken oder Ketten von E-H-Bindungen, wo es das chemische Element bezeichnet.
Salinos
In Salzhydrors beteiligt sich Wasserstoff an der ionischen Bindung wie Hydridanion, H-. Damit sich dies bildet, muss das Element notwendigerweise weniger elektronegativ sein; Andernfalls würde es seine Elektronen nicht an Wasserstoff aufgeben.
Daher werden Kochsalzlösung nur dann gebildet, wenn Wasserstoff mit sehr elektropositiven Metallen wie Alkalin und Alkalern reagiert.
Zum Beispiel reagiert Wasserstoff mit metallischem Natrium, um Natriumhydrid zu erzeugen:
2na (s) + h2(g) → 2Nah (s)
Oder mit Barium zur Herstellung von Bariumhydrid:
Ba (s) + h2(g) → Bah2(S)
Molekular
Molekulare Hydride sind noch besser bekannt als ionisch. Sie erhalten auch den Namen Wasserstoff Halogenuros, HX, wenn Wasserstoff mit einem Halogen reagiert:
Cl2(g) + h2(g) → 2HCl (g)
Hier nimmt der Wasserstoff an der kovalenten Bindung als h beteiligt+; Da sind die Unterschiede zwischen den Elektronegativitäten zwischen beiden Atomen nicht sehr groß.
Das gleiche Wasser kann als Sauerstoffhydrid (oder Wasserstoffoxid) angesehen werden, dessen Bildungsreaktion bereits ausgesetzt war. Sehr ähnlich ist die Reaktion mit Schwefel, um Schwefelwasserstoff zu ergeben, ein stinkendes Gas:
S (s) + h2(g) → h2S (g)
Aber von allen molekularen Hydrors ist Ammoniak das berühmteste (und vielleicht am schwierigsten zu synthetisierte):
N2(g) + 3h2(g) → 2nh3(G)
Anwendungen
Im vorherigen Abschnitt wurde bereits eine der Hauptverwältigungen von Wasserstoff angesprochen: als Rohstoff für die Entwicklung der Synthese, anorganische oder organische. Die Kontrolle dieses Gases hat normalerweise einen anderen Zweck, als es zu reagieren, um andere Verbindungen zu erzeugen, die sich von denen extrahiert haben.
Rohmaterial
- Es ist eines der Reagenzien für die Synthese von Ammoniak, das wiederum endlose industrielle Anwendungen hat, beginnend mit der Ausarbeitung von Düngemitteln, bis als Material für Stickstoffmedikamente.
- Es soll mit Kohlenmonoxid reagieren und somit Methanol produzieren, ein Reagenz, das hoch in Biokraftstoffen ist.
Reduktionsmittel
- Es ist ein Reduktionsmittel bestimmter Metalloxide, daher wird es bei metallurgischer Reduktion verwendet (bereits im Fall von Kupfer und anderen Metallen erklärt).
- Reduzieren Sie Fette oder Öle, um Margarine zu produzieren.
Öl Industrie
In der Ölindustrie wird Wasserstoff verwendet, um das Ölroroh in Verfeinerungsprozessen zu „hydrotratar“.
Zum Beispiel versucht es, große und schwere Moleküle in kleinen Molekülen und mit größerer Nachfrage auf dem Markt zu fragmentieren (Hydrocrascheus); Freisetzungsmetalle in Petroporphirinkäfigen (Hydrodesmetalisation); eliminieren Schwefelatome als h2S (Hydrodesulfurisierung); Oder reduzieren Sie doppelte Links, um reichhaltige Mischungen in Paraffinen zu erzeugen.
Kraftstoff
Wasserstoff selbst ist ein ausgezeichneter Kraftstoff für Raketen oder Raumfahrzeuge.
In kleinerem Maßstab wird diese Reaktion für das Design von Zellen oder Wasserstoffbatterien verwendet. Diese Zellen stehen jedoch vor den Schwierigkeiten, dieses Gas nicht ordnungsgemäß zu speichern. und die Herausforderung von völlig unabhängig von brennenden fossilen Brennstoffen.
Auf der positiven Seite, die als Brennstoff verwendet wird, setzt Wasserstoff nur Wasser frei; anstelle von Gasen, die Verschmutzungsmittel für die Atmosphäre und die Ökosysteme darstellen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui und Janming MA. (S.F.). Raumtemperaturstrukturen von festem Wasserstoff bei hohen Drücken. Staates Key Lab of Superhard Materials, Jilin University, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Flüssiger metallischer Wasserstoff: Ein Baustein für die flüssige Sonne. Abteilung für Radiologie, die Ohio State University, 395 W. 12th Ave, Columbus, Ohio 43210, USA.
- Die Bodner -Gruppe. (S.F.). Die Chemie von Wasserstoff. Abgerufen von: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Wasserstoff. Abgerufen von: in.Wikipedia.Org
- Wasserstoff Europa. (2017). Wasserstoffanwendungen. Gewonnen von: Hydrogeneurope.EU
- Foist Laura. (2019). Wasserstoff: Eigenschaften und Vorkommen. Lernen. Erholt von: Studium.com
- Jonas James. (4. Januar 2009). Die Geschichte von Wasserstoff. Abgerufen von: Altenergymag.com
- « Pichincha -Kampf Ursachen, Konsequenzen und Charaktere
- Pastorale neuartige Eigenschaften, Vertreter, Werke »

