Hydrolyse, was und Beispiele für Reaktionen bestehen
- 1993
- 80
- Timo Rabenstein
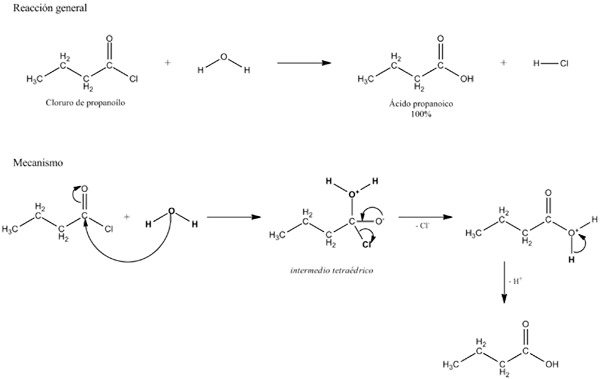
Der Hydrolyse Es ist eine chemische Reaktion, die sowohl bei anorganischen als auch bei organischen Molekülen oder Ionen auftreten kann und die die Beteiligung von Wasser für den Abbau seiner Bindungen beinhaltet. Sein Name stammt aus dem Griechischen, "Hydro" von Wasser und "Lyse" des Bruchs.
Das Wassermolekül, h2Oder es stellt ein Gleichgewicht mit den Ionen von Säuresalzen und schwachen Basen her und erscheint zum ersten Mal dieses Konzept in allgemeinen Studien zur Chemie und in der analytischen Chemie. Es ist daher eine der einfachsten chemischen Reaktionen.
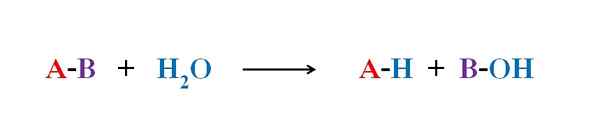 Allgemeine Gleichung für eine Hydrolysereaktion. Quelle: Gabriel Bolívar.
Allgemeine Gleichung für eine Hydrolysereaktion. Quelle: Gabriel Bolívar. In mehreren Beispielen der Hydrolyse kann Wasser allein keine bestimmte kovalente Bindung brechen. In diesem Fall beschleunigt oder katalysiert der Prozess durch Ansäuerung oder Alkalisierung des Mediums; das heißt in Gegenwart von Hionen3ENTWEDER+ oder oh-, bzw. Es gibt auch Enzyme, die die Hydrolyse katalysieren.
Die Hydrolyse nimmt einen besonderen Platz in Bezug auf Biomoleküle ein, da die Verbindungen, die ihre Monomere zusammenhalten. Zum Beispiel werden Zucker hydrolysiert, um Polysaccharide in ihren Monosacchariden zu zersetzen, dank der Wirkung von Glucosidase -Enzymen.
[TOC]
Was ist Hydrolyse?
Das obere Bild erklärt, woraus die Hydrolyse besteht. Beachte+ und oh-, Wo h+ endet mit a und oh- mit B. A-B reagiert mit einem Wassermolekül, das zwei Produkte entsteht, A-H und B-OH.
Hydrolyse ist daher die Reaktion gegen Kondensation. In der Kondensation sind zwei Produkte, um zu sagen, A-H und B-OH, durch die Freisetzung eines kleinen Moleküls gebunden: Wasser. In der Hydrolyse wird ein Molekül verbraucht, während es in Kondensation freigesetzt oder erzeugt wird.
Es kann Ihnen dienen: Carbonylgruppe: Eigenschaften, Eigenschaften, Nomenklatur, ReaktivitätZurück zum Beispiel des Zucker. Das A-B, die glucosidische Verbindung kann hydrolyzarisieren, um die beiden Monosaccharide getrennt und in Lösung zu entstehen, und das gleiche passiert dem Oligo und Polysacchariden, wenn sie Enzyme bei solchen Reaktionen vermitteln.
Beachten Sie, dass der Pfeil in dieser Reaktion, der von A-B, nur eine Adresse hat; Das heißt, es ist eine irreversible Hydrolyse. Viele Hydrolyse sind jedoch tatsächlich reversible Reaktionen, die ein Gleichgewicht erreichen.
Beispiele für Hydrolysereaktionen
- ATP
Der ATP ist stabil zwischen pH -Werten von 6,8 und 7,4. Bei extremen pH -Werten ist es jedoch spontan hydrolysiert. In Lebewesen wird die Hydrolyse durch Enzyme, die als Atasas bekannt sind, katalysiert:
ATP +h2O => adp +pi
Diese Reaktion ist stark exergonisch, da die Entropie von ADP größer ist als die von ATP. Gibbs freie Energievariation (δgº) beträgt - 30,5 kJ/mol. Die durch ATP -Hydrolyse erzeugte Energie wird in zahlreichen Endgonreaktionen verwendet.
Gekoppelte Reaktionen
In einigen Fällen wird die ATP -Hydrolyse zur Umwandlung einer Verbindung in einer Verbindung (b) verwendet.
A +ATP +H2Oder b +adp +pi +h+
- Wasser
Zwei Wassermoleküle können in einer scheinbaren Hydrolyse aufeinander reagieren:
H2Oder + h2Oder h3ENTWEDER+ + Oh-
Es ist, als ob eines dieser Wassermoleküle in H gebrochen werden+ und oh-, Ich werde das h verknüpfen+ Zum Sauerstoffatom des anderen Wassermoleküls, das das Hydriumionen H verursacht3ENTWEDER+. Diese Reaktion ist mehr als Hydrolyse um die Selbstpropotolyse von Wasser.
Kann Ihnen dienen: Aktivierungsenergie- Proteine
Proteine sind stabile Makromoleküle. Um ihre vollständige Hydrolyse zu erreichen, sind in den Aminosäuren, die sie bilden, extreme Bedingungen erforderlich. wie eine Konzentration von Salzsäure (6 m) und hohe Temperaturen.
Lebewesen sind jedoch mit einem enzymatischen Arsenal ausgestattet, das die Hydrolyse von Proteinen in Aminosäuren im Duodenum ermöglicht. Die an der Proteinverdauung beteiligten Enzyme werden von der Bauchspeicheldrüse fast vollständig sekretiert.
Es gibt Exopeptidase -Enzyme, die Proteine abbauen und an ihren Enden beginnen: Aminopeptidase durch das Amino -Ende und Carboxypeptidase über das Carboxyl -Ende. Endopeptidase -Enzyme üben ihre Wirkung innerhalb der Proteinkette aus, zum Beispiel: Tripsin, Pepsin, Chimotripsin usw.
- Inmitten und Estern
Die Amide, wenn sie in einem alkalischen Medium erhitzt werden, stammen aus einer Carbonsäure und einem Amin:
Rconh2 + H2O => rcoo- + NH2
Abneigungen in einem wässrigen Medium sind in Carboxylsäure und Alkohol hydrolysiert. Der Prozess wird entweder durch eine Base oder eine Säure katalysiert:
Rco-or ' +h2O => rcooh +r'oh
Dies ist die berühmte Saponification -Reaktion.
- Säure Base
Im Wasser werden mehrere Arten hydrolysiert, um die wässrige Umgebung zu säuern oder zu alkalisieren.
Zugabe eines Basissalzes
Natriumacetat, ein Basissalz, dissoziiert in Wasser, die NA -Ionen liefern+ (Natrium) und Cho3Gurren- (Acetat). Seine Basizität liegt daran, dass Acetat hydrolysiert, um Ionen OH zu erzeugen-, während Natrium unverändert bleibt:
CH3Gurren- + H2Oder ch3Cooh +oh-
Es kann Ihnen dienen: MethylalicylatOH- Er ist dafür verantwortlich, dass der pH -Wert zunimmt und grundlegend wird.
Zugabe eines Säuresalzes
Ammoniumchlorid (NH4Cl) wird durch das Chloridion (CL) gebildet-) aus Salzsäure (HCl), einer starken Säure und dem Ammoniumkation (NH4+) aus Ammoniumhydroxid (NH4Oh) eine schwache Basis. Das Cl- Es dissoziiert sich nicht im Wasser, aber das Ammoniumkation wird auf folgende Weise in das Wasser umgewandelt:
NH4+ + H2Oder NH3 + H3ENTWEDER+
Die Hydrolyse des Ammoniumkation produziert Protonen, die die Säure eines wässrigen Mediums erhöhen. Daher wird der Schluss gezogen, dass der NH4Cl ist ein Säuresalz.
Zugabe eines neutralen Salzes
Natriumchlorid (NaCl) ist ein Salzprodukt der Reaktion einer starken Base (NaOH) mit einer starken Säure (HCl). Beim Auflösen von Natriumchlorid im Wasser wird das Natriumkation erzeugt (Na+) und der Anion (Cl-). Beide Ionen dissoziieren sich nicht im Wasser, daher fügen sie nicht h hinzu h+ oder oh-, Halten Sie Ihren pH -Wert konstant.
Daher wird gesagt, dass Natriumchlorid ein neutrales Salz ist.
Verweise
- Mathews, c. K., Van Holde, K. UND. Und ahern, k. G. (2002). Biochemie. (Dritte Edition). Bearbeiten. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Helmestine, Anne Marie, ph.D. (13. Januar 2019). Hydrolyse: Definition und Beispiel. Erholt von: thoughtco.com
- Theresa Phillips. (28. April 2019). Eine Erklärung des Hydrolyseprozesses. Erholt von: THEABALANCE.com
- Die Herausgeber von Enyclopaedia Britannica. (16. November 2016). Hydrolyse. Encyclopædia Britannica. Erholt von: Britannica.com
- Wikipedia. (2019). Hydrolyse. Abgerufen von: in.Wikipedia.Org
- « Hyracotherium -Eigenschaften, Ernährung, Spezies, Reproduktion
- Geschichte der Ursprünge Videospiele zur virtuellen Realität »

