Katalytische Hydrierung
- 3451
- 886
- Said Ganzmann
 Die katalytische Hydrierung ist eine chemische Reaktion, bei der das Endergebnis die Zugabe von Wasserstoff zu einer anderen Verbindung ist. Quelle: Gabriel Bolívar
Die katalytische Hydrierung ist eine chemische Reaktion, bei der das Endergebnis die Zugabe von Wasserstoff zu einer anderen Verbindung ist. Quelle: Gabriel Bolívar Was ist katalytische Hydrierung?
Der katalytische Hydrierung Es ist die chemische Reaktion, durch die molekularer Wasserstoff in einer Verbindung bei höheren Geschwindigkeiten zugesetzt wird.
Die H -Molekula2 Nicht nur die kovalente Bindung zuerst brechen, sondern auch so kleine, effiziente Kollisionen zwischen ihr und der Verbindung dahin sind weniger wahrscheinlich, dass sie hinzugefügt werden.
Die Wasserstoffrezeptorverbindung kann durchaus organisch oder anorganisch sein. In organischen Verbindungen gibt es die meisten Beispiele für katalytische Hydrierung, insbesondere solche, die pharmakologische Aktivität haben oder Metalle in ihre Strukturen einbezogen haben (organometallische Verbindungen).
Wenn H hinzugefügt wird2 Zu einer Struktur voller Kohlenstoff ist, dass seine Unsättigung abnimmt, dh der Kohlenstoff erreicht den maximalen Grad der einfachen Verbindungen, die es bilden kann.
Daher h2 Doppelte (c = c) und dreifache (Cwerb) werden zugesetzt, obwohl es auch zu Carbonil -Gruppen hinzugefügt werden kann (C = O).
Somit reagieren Alkene und Alkine durch katalytische Hydrierung. Die oberflächlich analysierende Struktur kann vorhergesagt werden, ob sie hinzugefügt wird oder nicht H2 Erkennen Sie einfach Doppel- und Dreifach -Links.
Eigenschaften der katalytischen Hydrierung
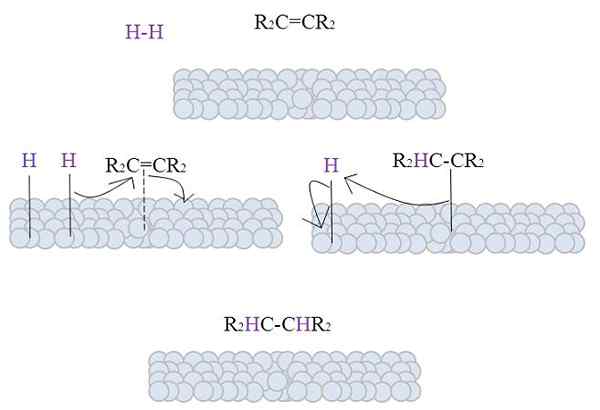
Das Bild zeigt den Mechanismus dieser Reaktion. Es ist jedoch notwendig, einige theoretische Aspekte anzugehen, bevor Sie es beschreiben.
Die Oberflächen der grauen Kugeln repräsentieren die Metallatome, die, wie es zu sehen ist.
Wasserstoffbrückenbindungen brechen
- Hydrierung ist eine exotherme Reaktion, dh sie fördert Wärme infolge der Bildung niedrigerer Energieverbindungen.
Kann Ihnen dienen: Acetanylid (C8H9no)- Die gebildeten C-H-Bindungen sind stabil, die eine größere Energie für einen späteren Bruch erfordern als die H-H-Bindung des molekularen Wasserstoffbedarfs.
- Die Hydrierung beinhaltet immer zuerst das Bruch des H-H-Links. Dieser Bruch kann wie in vielen Fällen homolitisch sein:
H-H => H ∙ + ∙ h
Oder heterolytisch, die beispielsweise gegeben werden können, wenn Zinkoxid Wasserstoff ist, ZnO:
H-H => H+ + H-
- Der Unterschied zwischen den beiden Brüchen liegt in der Verteilung von Verbindungselektronen. Wenn sie gleich (kovalent) gleich verteilt sind, behält jeder H ein Elektron bei, während, wenn die Verteilung ionisch ist, einer endet ohne Elektronen, h+, Und der andere gewinnt sie vollständig, h-.
- Beide Brüche sind in katalytischer Hydrierung möglich, obwohl Homolithikum der Entwicklung eines logischen Mechanismus dafür weichen kann.
Experimental
- Wasserstoff ist ein Gas, und daher muss es sprudeln und garantieren, dass er nur auf der Oberfläche der Flüssigkeit vorherrscht.
- Wasserstoffverbindung muss in einem Medium solubilisiert werden, sei es Wasser, Alkohol, Ästern oder ein flüssiges Amin. Andernfalls würde die Hydrierung sehr langsam gehen.
Die Verbindung auf Wasserstoff aufgelöst, muss auch ein Katalysator im Reaktionsmedium vorhanden sein. Dies wird für die Beschleunigung der Reaktionsgeschwindigkeit verantwortlich sein.
- Bei katalytischer Hydrierung werden normalerweise fein geteilte Metalle aus Nickel, Paladium, Platin oder Rhodium verwendet, die in fast allen organischen Lösungsmitteln unlöslich sind. Daher wird es zwei Phasen geben: eine Flüssigkeit mit gelöster Verbindung und Wasserstoff und einen Feststoff, die des Katalysators.
Es kann Ihnen dienen: Cruise for Crucible: Eigenschaften, Funktionen, verwenden Sie Beispiele- Diese Metalle liefern ihre Oberfläche so, dass Wasserstoff und Verbindung reagieren, damit Bindungsbrüche beschleunigt werden.
- Sie verringern auch den Verbreitungsraum der Spezies und erhöhen die Anzahl effektiver molekularer Kollisionen. Nicht nur das, sondern selbst die Reaktion findet in den Poren des Metalls statt.
Arten der katalytischen Hydrierung
Homogen
Es wird von homogener katalytischer Hydrierung gesprochen, wenn das Reaktionsmedium aus einer einzelnen Phase besteht. Hier die Verwendung von Metallen in ihren reinen Staaten, da sie unlöslich sind.
Stattdessen werden organomethalische Verbindungen dieser Metalle verwendet, die löslich sind und sich als hohe Erträge erwiesen haben.
Eine dieser organometallischen Verbindungen ist der Wilkinson -Katalysator: Tris Chlorid (Trifenylphin) Rodio [(C) [(C)6H5)3P]3Rhcl.
Diese Verbindungen bilden einen Komplex mit H2, Aktivieren Sie es für seine spätere Ergänzung zum Alken oder Alquino.
Die homogene Hydrierung zeigt viel mehr Alternativen als heterogen, da die Chemie in organometallischen Verbindungen reichlich vorhanden ist Holen Sie sich einen neuen Katalysator.
Heterogen
Heterogene katalytische Hydrierung hat, wie gerade erwähnt, zwei Phasen: eine Flüssigkeit und einen Feststoff.
Zusätzlich zu Metallkatalysatoren gibt es andere, die aus einer festen Mischung bestehen. Zum Beispiel der Lindlar -Katalysator, der aus Platin, Calciumcarbonat, Bleiacetat und Chinolin besteht.
Der Lindlar -Katalysator hat die Besonderheit, dass er für die Hydrierung von Alkenen schlecht ist. Es ist jedoch sehr nützlich für teilweise Hydrationen, dh es funktioniert hervorragend auf den Alkinen:
Kann Ihnen dienen: Lutecio: Struktur, Eigenschaften, Verwendungen, ErhaltenRCais + h2 => Rhc = chr
Mechanismus
Das Bild zeigt den Mechanismus der katalytischen Hydrierung unter Verwendung eines Pulvermetalls als Katalysator.
Die grauen Kugeln entsprechen der Metalloberfläche von z. B. Platinum. Das Molekül h2 (lila Farbe) befindet sich in der Nähe der Metalloberfläche sowie der Ersatztetra -Alken, R2C = Cr2.
Die h2 Wechselwirkung mit den Elektronen, die die Metallatome bewegen, und eine Bruch und Bildung eines H-M-zeitlichen Gliedes tritt auf, wobei m Metall ist. Dieser Prozess ist als bekannt als Chemisorption. Das heißt eine Adsorption durch chemische Kräfte.
Das Alken interagiert ähnlich, aber der Link bildet es mit seiner Doppelbindung (gepunktete Linie).
Die H-H-Bindung hat bereits dissoziiert und jedes Wasserstoffatom bleibt mit Metall verbunden. In ähnlicher Weise ist es mit Metallzentren in biologischen Katalysatoren, die einen H-M-H-Vermittlerkomplex bilden.
Anschließend tritt eine Migration von A H in Richtung der Doppelbindung auf, und dies öffnet sich und bildet eine Verbindung mit dem Metall. Dann schließt sich der verbleibende H den anderen Kohlenstoff aus der ursprünglichen Doppelbindung an, und das erzeugte Alkane wird schließlich freigesetzt, R2HC-chr2.
Dieser Mechanismus wird so oft wie nötig wiederholt, bis alle h2 vollständig reagiert haben.
Verweise
- Carey, f. (2008). Organische Chemie. Mc Graw Hill.
- Shiver & Atkins (2008). Anorganische Chemie. Mc Graw Hill.
- Lew, J. (S.F.). Katalytische Hydrierung von Alkenen. Chem erholt sich.Librettexts.Org
- Was ist katalytische Hydrierung? - Mechanismus und Reaktion. Studie erholt sich.com

