Hydrolasasestruktur, Funktionen, Beispiele

- 2582
- 156
- René Riediger
Der Hydrolase Sie sind Enzyme, die für die Hydrolysierung verschiedener Arten chemischer Verbindungen in vielen verschiedenen Verbindungen verantwortlich sind. Unter den Hauptverbindungen, dass Hydrolyz die Ester-, Glucosid- und Peptidverbindungen sind.
In der Gruppe der Hydrolasen wurden mehr als 200 verschiedene Enzyme klassifiziert und mindestens 13 einzelne Sätze gruppiert. Seine Klassifizierung basiert im Wesentlichen auf der Art der chemischen Verbindung, die als Substrat dient.
 Grafikmodellierung mit Bioinformatikwerkzeugen der Struktur einer Hydrolase (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) über Wikimedia Commons)
Grafikmodellierung mit Bioinformatikwerkzeugen der Struktur einer Hydrolase (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) über Wikimedia Commons) Hydrolasen sind für die Verdauung von Nahrungsmitteln im Darm von Tieren unverzichtbar, da sie für die Abbau eines großen Teils der Verbindungen verantwortlich sind.
Diese Enzyme funktionieren in wässrigen Medien, da sie Wassermoleküle um sie herum benötigen, um den Verbindungen zu erweitern, sobald die Moleküle aufgeteilt sind. In einfachen Worten führen Hydrolasen eine hydrolytische Katalyse der Verbindungen durch, auf die sie wirken.
Wenn beispielsweise eine Hydrolase eine kovalente C-C-Bindung durchbricht, ist das Ergebnis normalerweise eine C-O-Gruppe und eine C-H-Gruppe.
[TOC]
Struktur
Hydrolasen sind wie viele Enzyme organisierte globuläre Proteine in komplexen Strukturen, die durch intramolekulare Wechselwirkungen organisiert werden.
Hydrolasen binden wie alle Enzyme an ein oder mehrere Substratmoleküle in einer Region seiner Struktur, die als "aktives Zentrum" bezeichnet wird. Diese Stelle ist eine Tasche oder Spalte, die von vielen Aminosäureresten umgeben ist, die den Griff oder die Vereinigung des Substrats erleichtern.
Jede Art von Hydrolase ist spezifisch für ein bestimmtes Substrat, das durch seine Tertiärstruktur und durch die Bildung von Aminosäuren bestimmt wird, die ihren aktiven Platz machen. Diese Spezifität wurde von Emil Fischer didaktisch als eine Art "Schlüssel und Schloss" angehoben.
Kann Ihnen dienen: Polymerase: Eigenschaften, Struktur und FunktionenGegenwärtig ist bekannt, dass das Substrat im Allgemeinen Veränderungen oder Verzerrungen in der Bildung von Enzymen induziert und dass Enzyme wiederum die Struktur des Substrats verzerren, um sicherzustellen.
Funktionen
Alle Hydrolasen haben die Hauptfunktion des Brechens chemischer Bindungen zwischen zwei Verbindungen oder innerhalb der Struktur desselben Moleküls.
Es gibt Hydrolasen, um fast jede Art von Verbindung zu brechen: Einige beeinträchtigen die Esterbindungen zwischen Kohlenhydraten, anderen Peptidbindungen zwischen Proteinaminosäuren, anderen Carboxylbindungen usw.
Der Zweck des durch ein Hydrolase -Enzyms katalysierten chemischen Bindungsverfahrens variiert erheblich. Smozym zum Beispiel ist für die Hydrolyse chemischer Bindungen mit Organismusschutzzwecken verantwortlich.
Dieses Enzym verschlechtert die Verbindungen, die mit den Verbindungen in der Zellwand der Bakterien zusammenhalten, mit dem Ziel, den menschlichen Körper vor bakterieller Proliferation und einer möglichen Infektion zu schützen.
Nucleas sind „Phosphatase“ -Ezyme, die die Fähigkeit haben, Nukleinsäuren abzubauen, die auch einen Zellverteidigungsmechanismus gegen DNA- oder RNA -Viren darstellen können.
Andere Hydrolasen, wie die des Typs "Proteasen".
Sogar Hydrolasen sind an verschiedenen Energieproduktionsereignissen im Zellstoffwechsel beteiligt, da Phosphatasen die Freisetzung von Phosphatmolekülen aus hohen Energiensubstraten wie Pyruvat in Glykolyse katalysieren.
Es kann Ihnen dienen: SojabohnengriffBeispiele für Hydrolasasen
Unter der großen Vielfalt von Hydrolasen, die Wissenschaftler identifiziert haben.
Darunter befinden sich die Glätte, die Protease -Serin, die endonukle und glucosidase oder glykosyraeous phosphatasen.
Die Glätte
Enzyme dieser Art Bruch. Dies führt normalerweise zu einer totalen Lyse der Bakterien.
Smozyme verteidigen den Körper von Tieren von bakteriellen Infektionen und sind in Körpersekreten in Geweben, die in Kontakt mit der Umwelt stehen, reichlich vorhanden, wie zum Beispiel Tränen, Speichel und Schleimhaut.
Das glatte Hühnchenei war die erste Proteinstruktur, die durch X -Strahlen kristallisierte. Diese Kristallisierung wurde von David Phillips im Jahr 1965 am London Real Institute gemacht.
Das aktive Zentrum dieses Enzyms besteht aus dem Asparagin-Alanin-Mechanin-Peasparagin-Glycin-Glycin-Peragin-Plain-Methionin-Peptid (NAM-NAG-NAM).
Proteaseserin
Die Enzyme dieser Gruppe sind für hydrolyse Peptidbindungen in Peptiden und Proteinen verantwortlich. Die am häufigsten untersuchten sind Trpsin und Chimotripsin; Es gibt jedoch viele verschiedene Arten von Proteasen, die sich in Bezug auf die Spezifität des Substrats und seines Katalysemechanismus variieren.
Die "Proteasen" sind durch den Besitz einer nukleophilen Aminosäure vom Serin -Typ gekennzeichnet. Proteasas Serin können auch eine Vielzahl von Esterverbindungen brechen.
Kann Ihnen dienen: Was ist die chemische Zusammensetzung der Lebewesen??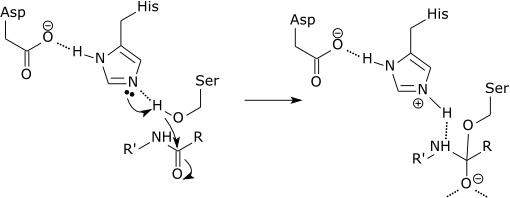 Grafikschema der Wirkung einer Protease, die einen Peptidverbindung in der Histidin-Aminosäure durchbricht (Quelle: Zephyris bei der englischen Sprachwikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons)
Grafikschema der Wirkung einer Protease, die einen Peptidverbindung in der Histidin-Aminosäure durchbricht (Quelle: Zephyris bei der englischen Sprachwikipedia [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/)] über Wikimedia Commons) Diese Enzyme schneiden Peptide und Proteine auf unspezifische Weise. Alle zu schneidenden Peptide und Proteine müssen jedoch durch das N-terminale Ende der Peptidverbindung an die aktive Stelle des Enzyms gebunden sein.
Jede kurze Protease ist genau die Amida-Bindung, die sich zwischen dem C-terminalen Ende der Aminosäure im Carboxylende und dem Amin-Amin-Amin-Amin in Richtung des N-terminalen Ende des Peptids bildet.
Nukleasephosphatasen
Diese Enzyme Katalog. Es gibt viele verschiedene Arten dieser Enzyme, da sie spezifisch für die Art der Nukleinsäure und die Schneidstelle sind.
 Grafikschema der Wirkung einer Endonuklease hydrolysiert eine Phosphodiéster-Bindung (Quelle: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Grafikschema der Wirkung einer Endonuklease hydrolysiert eine Phosphodiéster-Bindung (Quelle: J3D3 [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Endonukleasen sind im Bereich der Biotechnologie unverzichtbar, da Wissenschaftler die Genome von Organismen modifizieren können, indem sie Fragmente der genetischen Informationen fast jeder Zelle schneiden und ersetzen.
Die Endonukleasen machen das Schneiden der stickstoffhaltigen Grundlagen in drei Schritten. Die erste ist eine nukleophile Aminosäure, dann wird eine Zwischenstruktur mit negativer Belastung gebildet, die die Phosphatgruppe anzieht und schließlich die Verbindung zwischen den beiden Basen bricht.
Verweise
- Davies, g., & Henrissat, b. (1995). Strukturen und Mechanismen von Glycosylhydrolas. Struktur, 3 (9), 853-859.
- Lehninger, a. L., Nelson, d. L., Cox, m. M., & Cox, m. M. (2005). Lehninger Prinzipien der Biochemie. Macmillan.
- Mathews, a. P. (1936). Prinzipien der Biochemie. W. Holz.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Harpers illustrierte Biochemie. 28 (p. 588). New York: McGraw-Hill.
- Ollis, d. L., Cheeeah, e., Cygler, m., Dijkstra, geb., Folow, f., Franken, s. M.,… & Sussman, J. L. (1992). Die α/β -Hydrolase -Falte. Engineering Protein, Design und Selektion, 5 (3), 197-211.

