Hydroxiapatit

- 4917
- 1247
- Jasmine Kupprion
Wir erklären, was Hydroxylapatit, seine Struktur, wie es synthetisiert wird, seine Verwendung sowie seine physikalischen und chemischen Eigenschaften
 Hydroxiapatit. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0, CC BY-SA 3.0, über Wikimedia Commons
Hydroxiapatit. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0, CC BY-SA 3.0, über Wikimedia Commons Was ist Hydroxyapatit?
Der Hydroxiapatit Es ist ein Calciumphosphatmineral, dessen chemische Formel CA ist10(Po4)6(OH)2. Zusammen mit anderen Mineralien und organischen und verdichteten organischen Substanz bildet es den Rohstoff, der als Phosphorgestein bekannt ist. Der Begriff Hydroxi bezieht sich auf Anion OH-.
Wenn anstelle dieses Anion Fluorid wäre, würde das Mineral Fluorapatita (CA) genannt10(Po4)6(F)2; Und so mit anderen Anionen (CL-, Br-, CO32-, usw.). Ebenso ist Hydroxylapatit die wichtigste anorganische Komponente von Knochen und Zahnschmelz, die vorwiegend in einem Kristallin vorhanden ist.
Es ist also ein wichtiges Element in den Knochengeweben der Lebewesen. Seine große Stabilität gegen andere Calciumphosphate ermöglicht es ihm, physiologische Bedingungen zu unterstützen und den Knochen ihre charakteristische Härte zu verleihen. Hydroxiapatit ist nicht allein: Sie erfüllt seine Funktion, begleitet von Kollagen, fibröses Protein von Konjunktivgeweben.
Hydroxylapatit (oder Hydroxylapatit) enthält CA -Ionen2+, Andere Kationen können aber auch in seiner Struktur untergebracht werden (mg2+, N / A+), Verunreinigungen, die an anderen biochemischen Prozessen der Knochen beteiligt sind (z. B. ihr Umbau).
Hydroxyapatitstruktur
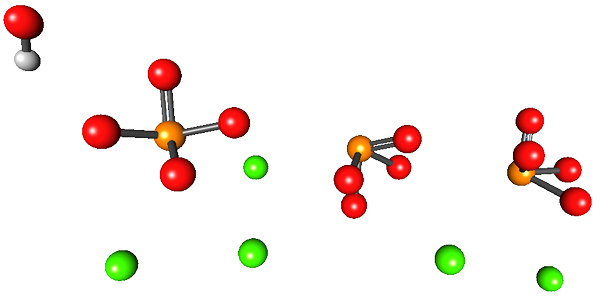
Das überlegene Bild zeigt die Struktur von Calciumhydroxylapatit. Alle Kugeln belegen das Volumen einer halben hexagonalen "Schublade", in der die andere Hälfte mit der ersten identisch ist.
In dieser Struktur entsprechen die grünen Kugeln den CA -Kationen2+, Während die roten Kugeln zu Sauerstoffatomen, orange bis phosphoratome und das Weiß zum OH -Wasserstoffatom-.
Phosphate -Ionen in diesem Bild haben den Defekt, keine tetraedrische Geometrie zu zeigen. Stattdessen wirken sie wie quadratische Basispyramiden.
Kann Ihnen dienen: GlaskörperzustandOH- vermittelt den Eindruck, dass es sich weit entfernt von der CA befindet2+. Die kristalline Einheit kann sich jedoch auf dem Dach des ersten wiederholen und so die enge Nähe zwischen beiden Ionen zeigen. Außerdem können diese Ionen durch andere ersetzt werden (NA+ und f-, Zum Beispiel).
Hydroxylapatit -Synthese
Hydroxylapatit kann durch Reaktion von Calciumhydroxid mit Phosphorsäure synthetisiert werden:
10 CA (OH)2 + 6 h3Po4 => Ca10(Po4)6(OH)2 + 18 h2ENTWEDER
Hydroxiapatita (ca10(Po4)6(OH)2) wird durch zwei Formel -CA -Einheiten ausgedrückt5(Po4)3Oh.
Ebenso kann Hydroxyapatit durch die folgende Reaktion synthetisiert werden:
10 ca (nein3)2.4H2O + 6 NH4H2Po4 => Ca10(Po4)6(OH)2 + 20 NH4NEIN3 + 52 h2ENTWEDER
Kontrolle der Niederschlagsgeschwindigkeit ermöglicht es dieser Reaktion, Hydroxylapatit -Nanopartikel zu erzeugen.
Hydroxyapatitkristalle

Die Ionen sind verdichtet und wachsen zu einer starren und resistenten Biokritik. Dies wird als Biomaterial der Knochenmineralisierung verwendet.
Es braucht jedoch Kollagen, organische Unterstützung, die als Wachstumsform dient. Diese Kristalle und ihre komplizierten Bildungsprozesse hängen vom Knochen (oder Zahn) ab.
Diese Kristalle wachsen mit organischer Substanz imprägniert, und die Anwendung elektronischer Mikroskopie -Techniken beschreibt sie in den Zähnen als Aggregate mit Stangenformen, die als Prismen bezeichnet werden.
Hydroxylapatit verwendet
Medizinischer und zahnärztlicher Gebrauch
Aufgrund seiner Ähnlichkeit in Größe, Kristallographie und Zusammensetzung mit dem harten menschlichen Gewebe ist Nanohydroxylapatit bei Prothesen attraktiv für die Verwendung. Außerdem ist Nanohydroxyapatit biokompatibel, bioaktiv und natürlich und nicht giftig oder entzündlich.
Infolgedessen hat die Nanohydroxyapatit -Keramik eine Vielzahl von Anwendungen, darunter:
- In der Knochen -Tejido -Operation wird es bei der Füllung von Hohlräumen in orthopädischen, traumatologischen, maxillofazialen und Zahnarztpraxen verwendet.
- Es wird als orthopädische und zahnärztliche Beschichtung verwendet. Es ist ein Desensibilisierungsmittel, das zum Zahnaufhellen verwendet wird. Er wird auch als Remineralisierungsmittel bei Zahnpasten und frühen Kariesbehandlung verwendet.
- Edelstahl- und Titanimplantate werden häufig mit Hydroxyapatit bedeckt, um ihre Ablehnungsgeschwindigkeit zu verringern.
- Es ist eine Alternative zu alogenen und xenogenen Knochentransplantaten. Die Heilungszeit ist in Gegenwart von Hydroxylapatit kürzer als in seiner Abwesenheit.
- Synthetische Mimetiza von Nanohidroxyapatit zu Hydroxyapatit, die auf natürliche Weise in Dentin und Apatit Enmalic vorhanden ist.
Andere Verwendungen von Hydroxyapatiten
- Hydroxylapatit wird in den Luftfiltern von Kraftfahrzeugen verwendet, um ihre Effizienz bei der Absorption und Zersetzung von Kohlenmonoxid (CO) zu erhöhen. Dies reduziert die Umweltverschmutzung.
- Ein Alginat-Hydroxyapatit-Komplex wurde synthetisiert, dass Feldtests gezeigt haben, dass er Fluorid durch den Ionenaustauschmechanismus aufnehmen kann.
- Hydroxiapathit wird als chromatographisches Medium für Proteine verwendet. Dies hat positive Gebühren (ca++) und negativ (po4-3), damit es mit elektrisch geladenen Proteinen interagieren und seine Trennung durch Ionenaustausch ermöglichen kann.
- Hydroxylapatit wurde auch als Unterstützung für elektrophootische Nukleinsäuren verwendet. Es ist möglich, die DNA von der RNA sowie die DNA eines einfachen Strangs der beiden Stränge zu trennen.
Physikalische und chemische Eigenschaften
Hydroxyapatit ist ein weißer Feststoff, der graue, gelbe und grünliche Töne erwerben kann. Wie ein kristalliner Feststoff ist es hohe Fusionspunkte, was auf die starken elektrostatischen Wechselwirkungen hinweist; Für Hydroxyapatit ist dies 1100 ºC.
Es ist dichter als Wasser mit einer Dichte von 3,05 - 3,15 g/cm3. Darüber hinaus ist es praktisch unlöslich in Wasser (0,3 mg/ml), was auf Phosphationen zurückzuführen ist.
In sauren Medien (wie in HCl) ist es jedoch löslich. Diese Löslichkeit ist auf die Bildung von CACl zurückzuführen2, Hoch lösliches Wassersalz. Ebenso sind Phosphate Proton (HPO42- und h2Po4-) und in einem besseren Grad mit Wasser interagieren.
Die Löslichkeit von saurem Hydroxylapatit ist für die Pathophysiologie von Karies wichtig. Bakterien in der Mundhöhle sezernieren Milchsäure, Produkt der Glukosefermentation, die den pH -Wert der Zahnoberfläche auf weniger als 5 verringert, sodass sich der Hydroxylapatit auflöst beginnt.
Kann Ihnen dienen: Sublimation: Konzept, Prozess und BeispieleDas Fluorid (f-) Sie können OH -Ionen ersetzen- In der kristallinen Struktur. In diesem Fall bietet es Resistenz gegen den Hydroxylapatit des Zahnschmelzes vor Säuren.
Möglicherweise kann dieser Widerstand auf die Unlöslichkeit von CAF zurückzuführen sein2 gebildet und weigert sich, das Glas zu "verlassen".
Verweise
- Shiver & Atkins. (2008). ANORGANISCHE CHEMIE. (Viertes Ausgabe., P. 349, 627). Mc Graw Hill.
- Fluidinova. (2017). Hydroxylapatit. Aus Fluidinova abgerufen.com
- GAIABULBANIX. (5. November 2015). Hydroxyapatit. [Figur]. Von Commons geborgen.Wikimedia.Org
- Martin.Neitsov. (25. November 2015). Hüdroksüapatiidi Kristallid. [Figur]. Von Commons geborgen.Wikimedia.Org
- Wikipedia. (2018). Hydroxylapatit. Abgerufen von.Wikipedia.Org
- Fiona Petchey. Knochen. C14dating geborgen.com

