Aluminiumhydrid (ALH3) -Struktur, Eigenschaften, verwendet
- 4566
- 1249
- Ibrahim Steuk
Er Aluminiumhydrid Es ist eine anorganische Verbindung, deren chemische Formel Alh ist3. Obwohl es einfach zu sein scheint, ist es tatsächlich eine etwas komplizierte Substanz. Aufgrund der kristallinen Helligkeit, die in seinem Festen auftreten kann3+ und h-.
Seine Eigenschaften zeigen jedoch etwas anderes: Es ist ein polymerer Feststoff, dessen treueste Darstellung vom Typ wäre (ALH3)N, Sein N Die Anzahl der monomeren Einheiten ALH3 Das würde eine Glaskette oder Schicht integrieren. Daher die ALH3 Es ist eines dieser Polymere, die es schafft, eine kristalline Struktur zu übernehmen.
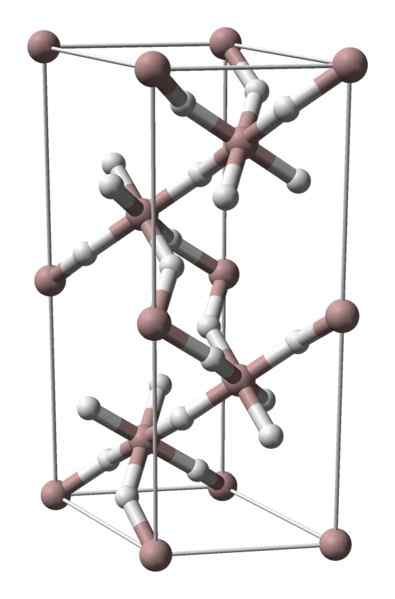 Kristallstruktur von Aluminiumhydrid. Quelle: Benjah-BMM27 / Public Domain
Kristallstruktur von Aluminiumhydrid. Quelle: Benjah-BMM27 / Public Domain Aluminiumhydrid ist nicht massiv mit viel kommerzieller Verbreitung, daher sind die verfügbaren Bilder knapp. Es wird speziell für die organische Synthese verwendet, wo es als starkes Reduktionsmittel dient. Es nimmt auch einen besonderen Platz im technologischen Fortschritt von Materialien ein und ist eine vielversprechende Alternative zur Wasserstoffspeicherung.
Diese Verbindung, auch Alano genannt, hält eine enge Beziehung zum Lialh4, deren Namen Aluminium- und Lithiumhydrid-, Lithium -Alanat- oder Lithium -Tetrahydroalumination sind. Obwohl es Polymereigenschaften und eine thermische Metastabilität aufweist, tritt sie in sieben Polymorphen mit unterschiedlichen kristallinen Morphologien auf.
[TOC]
Struktur
Koordinierungen
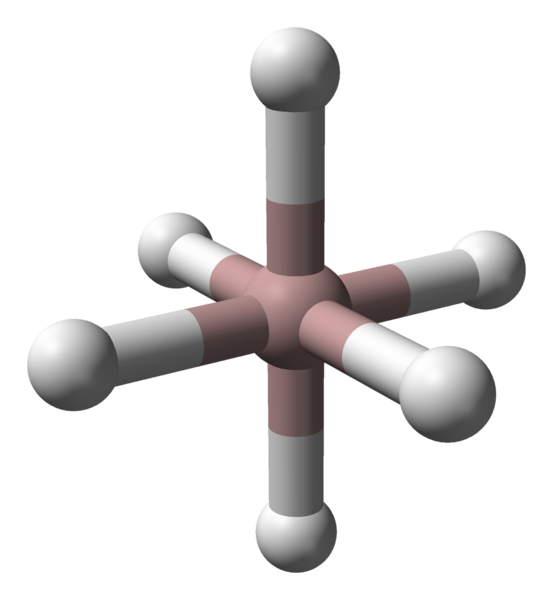
 Oktaedrische Koordination von Aluminiumkationen im Alh3 -Kristall. Quelle: Benjah-BMM27 / Public Domain.
Oktaedrische Koordination von Aluminiumkationen im Alh3 -Kristall. Quelle: Benjah-BMM27 / Public Domain. Unabhängig vom Polymorph oder der betrachteten kristallinen Phase ist die Koordination zwischen Aluminium und Wasserstoffatomen konstant. Im oberen Bild wird beispielsweise wie im ersten Bild die Koordinationsoktaeder für Aluminiumatome (braune Kugel) im ersten Bild gezeigt.
Kann Ihnen dienen: stöchiometrische GesetzeJedes Atom ist von sechs Stunden umgeben, um sechs Al-H-Verbindungen herzustellen. Die Art und Weise, wie Oktaeder im Weltraum ausgerichtet sind.
Andererseits wird jedes H-Atom mit zwei Atomen al koordiniert, wobei eine Al-H-Al-Bindung festgelegt wird, die durch eine 3C2E-Verbindung gerechtfertigt werden könnte (3 Zentren-2-Elektronen). Dieser Link ist verantwortlich für den Beitritt zu mehreren Octaedros ALH6 im gesamten Alano -Kristall.
Isoliertes Molekül
Der Alh3 Es wird aufgrund von ALH -Netzwerken als polymer angesehen6 das integriert das Glas. Um ein einzelnes Alano -Molekül zu isolieren, ist es erforderlich, niedrige Drücke in einer inerten Atmosphäre von Edelgas anzuwenden. Auf diese Weise bricht das Polymer und freisetzt Alh -Moleküle3 der trigonalen flachen Geometrie (analog zu BH3).
Andererseits ist es möglich, zwei ALH zu verringern3 zu bilden a2H6, Wie beim Diborano, b2H6. Um dies zu erreichen, ist jedoch die Verwendung von festem Wasserstoff erforderlich, sodass sie möglicherweise nicht viel industrielle oder kommerzielle langfristige Wert aufweist.
Polymorphen
Der Alano oder Alh3 Es ist in der Lage, bis zu sieben Polymorphs zu bilden: α, α ', β, γ, δ, ε und ζ, von denen α für Temperaturänderungen am stabilsten ist. Das α-alh3 Es zeichnet sich durch eine kubische Morphologie und eine hexagonale kristalline Struktur aus. Es ist tendenziell das Produkt, in dem die anderen Polymorphen transformiert werden, wenn sie thermische Destabilisierung erleiden.
Die Morphologie von γ-alh3, Andererseits fällt es sich aus, dass es vom Typ Nadeln ist. Deshalb der ALH3 Feststoff kann eine Mischung aus mehr als zwei Polymorphen enthalten und variierte Kristalle am Mikroskop aufweisen.
Eigenschaften
Aussehen
Aluminiumhydrid ist ein farbloses oder weißliches festes, kristallines Aussehen mit der Tendenz, Nadelformen zu zeigen.
Kann Ihnen dienen: Sulfonsäure: Struktur, Nomenklatur, Eigenschaften, verwendetMolmasse
29.99 g/mol o 30 g/mol
Schmelzpunkt
150 ºC. Aber es beginnt von 105 ° C zu brechen.
Wasserlöslichkeit
Hoch, dann mit ihr reagieren.
Löslichkeit
Unlöslich in Diethyléter und apolaren Lösungsmitteln wie Benzol und Pentan. Reagiert mit Alkoholen und anderen polaren Lösungsmitteln.
Zersetzung
Der Alh3 Es ist anfällig, je nach externen Bedingungen, der Morphologie und der thermischen Stabilität ihrer Kristalle oder der Verwendung von Katalysatoren bei unterschiedlichen Geschwindigkeiten zu zersetzen. Wenn dies der Fall ist, setzt es Wasserstoff frei und verwandelt sich in Metallaluminium:
2Alh3 → 2al + 3h2
In der Tat stellt diese Zersetzung anstatt ein Problem zu sein.
Adduktbildung
Wenn der Alh3 Es reagiert nicht mit dem Lösungsmittel irreversibel, sondern ein Addukt, dh eine Art Komplex. Zum Beispiel können Sie einen Komplex mit Trimethylamin, ALH, bilden3· 2n (Cho3)3, Mit der Tetrahydrofurano, ALH3· THF oder mit Diätileter Alh3· Et2ENTWEDER. Letzteres war das bekannteste, als die Synthese oder das Erhalten des Alano 1947 eingeführt wurde.
Erhalten
Die ersten Erscheinungen des ALH3 Sie stammen aus den 1942 und 1947, da sie letztes Jahr, als seine Synthese unter Verwendung von Lialh vorgestellt wurde4 In einem Diethylmedium:
3lialh4 + Alcl3+ NET2O → 4alh3 · NET2O + 3licl
Die ätherische Lösung, ALH3 · NET2Oder er musste sich enttäuschen, um den ET zu beseitigen2Oder und holen Sie sich die ALH3 rein. Zusätzlich zu diesem Problem sollte die LiCl aus dem Medium der Produkte beseitigt werden.
So wurde von 1950 bis 1977 neue Synthese entwickelt, um bessere ALH -Ausbeuten zu erhalten3, sowie reinste Feststoffe und bessere thermische und morphologische Eigenschaften. Wenn Sie die verwendeten Mengen, Schritte und Instrumente ändern, ist es möglich, ein Polymorph über dem anderen zu erhalten. Α-alh3 Es ist normalerweise das Mehrheitsprodukt.
Es kann Ihnen dienen: Alilo: Allyic Unit, Carbocation, Radical, BeispieleAndere Synthesemethoden bestehen darin, die Elektrochemie zu verwenden. Zu diesem Zweck werden eine Aluminiumanode und eine Platinkathode verwendet. In der Anode geht die folgende Reaktion ab:
3alh4- - + Zum3+ + NThf → 4alh3 · NThf + 3e- -
Während im Kathoden metallisches Natrium erhalten wird. Dann der Alh3 · NTHF erfährt sich auch entschärft, um THF zu beseitigen und schließlich die ALH zu erhalten3.
Anwendungen
Reduktionsmittel
Der Alh3 Es dient dazu, bestimmte funktionelle Gruppen organischer Verbindungen wie Carboxysäuren, Ketone, Aldehyde und Ester zu reduzieren. Praktisch fügt es Wasserstoffe hinzu. Zum Beispiel kann ein Sterpunkt in Gegenwart einer Nitro -Gruppe auf einen Alkohol reduziert werden:
 Reduktion eines Stermarks mit Aluminiumhydrid. Quelle: Ingwer / Public Domain.
Reduktion eines Stermarks mit Aluminiumhydrid. Quelle: Ingwer / Public Domain. Wasserstoffreservoir
Aluminiumhydrid ist eine Alternative, um als Wasserstoffreservoir zu dienen und damit in Geräten, die mit Wasserstoffbatterien arbeiten, portable zu dienen. Die aus h gewonnenen Volumina2 entsprechen einem größeren Volumen von Doppel als ALH3.
Das Alh haben3, und zerlegt es kontrolliert, kann eine gewisse wünschenswerte Menge H freigesetzt werden2 Wann immer. Daher könnte es als Raketentreibstoff und all jener Energieanwendungen verwendet werden, die die Wasserstoffverbrennung nutzen möchten.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Hydrid -Aluminium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2020). Hydrid -Aluminium. Pubchem -Datenbank., CID = 14488. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- J. Graetz et al. (2011). Aluminiumhydrid als Wasserstoff- und Energiespeichermaterial: Vergangenheit, Gegenwart und Zukunft. Elsevier b.V.
- Xu Bo et al. (2014). Vorbereitung und thermische Eigenschaften von Studenthydrid -Polymorphen. doi.org/10.1016/j.Vakuum.2013.05.009
- « Lineare Variationskonzept, Beispiele, Übung gelöst
- Erdform und ihre physischen und astronomischen Folgen »

