Lithiumhydridstruktur, Eigenschaften, erhalten, verwendet, verwendet
- 3748
- 1020
- Ivan Pressler
Er Lithiumhydrid Es ist ein kristalliner anorganischer Feststoff, dessen chemische Formel Lih ist. Es ist das leichte anorganische Salz, sein Molekulargewicht beträgt nur 8 g/mol. Es wird durch die Vereinigung eines Lithium -Ion li gebildet+ und ein Hydrid -H -Ion-. Beide sind durch eine ionische Bindung vereint.
Lih hat einen hohen Schmelzpunkt. Es reagiert leicht mit Wasser und in der Reaktion tritt Wasserstoffgas auf. Es kann durch Reaktion zwischen geschmolzenem Lithiummetall und Wasserstoffgas erhalten werden. Es wird häufig bei chemischen Reaktionen verwendet, um andere Hydrors zu erhalten.
 Lithiumhydrid, Lih. Kein maschinenlesbarer Autor zur Verfügung gestellt. Jtiago übernommen (basierend auf Urheberrechtsansprüchen). [Public Domain]. Quelle: Wikimedia Commons.
Lithiumhydrid, Lih. Kein maschinenlesbarer Autor zur Verfügung gestellt. Jtiago übernommen (basierend auf Urheberrechtsansprüchen). [Public Domain]. Quelle: Wikimedia Commons. LIH wurde zum Schutz vor gefährliche Strahlung verwendet, wie sie in Kernreaktoren gefunden wurden. Diese sind Alpha, Beta, Gammastrahlung, Protonen, X -Strahlen und Neutronen.
Es wurde auch zum Schutz der Materialien der Raumraketen vorgeschlagen, die durch den nuklearen thermischen Antrieb bewegt wurden. Studien werden sogar als Schutz des Menschen gegen kosmische Strahlung bei zukünftigen Reisen zum Planeten Mars verwendet.
[TOC]
Struktur
In Lithiumhydrid hat Wasserstoff eine negative Belastung H-, Nun, ein Elektron hat das Metall gestohlen, das in Form von Ion Li ist+.
Elektronische Kationskonfiguration Li+ Es ist: [er] 1s2 das ist sehr stabil. Und die elektronische Struktur von Hydrid H- Es ist: 1s2, das ist auch sehr stabil.
Das Kation und das Anion binden durch elektrostatische Kräfte.
Der Lithiumhydridkristall hat die gleiche Struktur wie das Natriumchlorid, dh eine kubische kristalline Struktur.
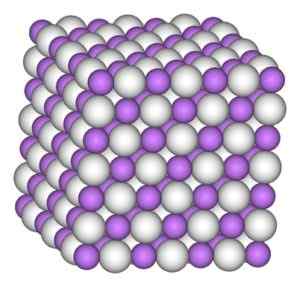 Kubische kristalline Struktur von Lithiumhydrid. Autor: Benjah-BMM27. Quelle: Wikimedia Commons.
Kubische kristalline Struktur von Lithiumhydrid. Autor: Benjah-BMM27. Quelle: Wikimedia Commons. Nomenklatur
- Lithiumhydrid
- Lih
Eigenschaften
Körperlicher Status
Weißer oder farbloser kristalline Feststoff. Kommerzielle LiH kann aufgrund des Vorhandenseins kleiner Mengen an Lithiummetall graublau sein.
Molekulargewicht
8 g/mol
Schmelzpunkt
688 ºC
Siedepunkt
Es zersetzt sich bei 850 ° C.
Selbstdirektionstemperatur
200 ºC
Dichte
0,78 g/cm3
Löslichkeit
Mit Wasser reagieren. Es ist unlöslich in Ether und Kohlenwasserstoffen.
Andere Eigenschaften
Lithiumhydrid ist viel stabiler als die Hydros der anderen alkalischen Metalle und kann ohne Zersetzung geschmolzen werden.
Kann Sie servieren: Trockener BatterieEs wird nicht von Sauerstoff betroffen, wenn es bei Temperaturen unter rot erhitzt wird. Es wird auch nicht von Chlor CL betroffen2 und HCl Salzsäure.
LIH -Kontakt mit Wärme und Luftfeuchtigkeit verursacht eine exotherme Reaktion (erzeugt Wärme) und Wasserstoffentwicklung H2 und Lithiumhydroxid lioh.
Es kann einen feinen Staub bilden, der in Kontakt mit Flammen, Wärme oder oxidierenden Materialien ausnutzen kann. Sie sollten sich nicht mit Lachgas oder flüssigem Sauerstoff wenden, wie es ausnutzen oder einschalten kann.
Es verdunkelt sich durch Licht ausgesetzt.
Erhalten
Lithiumhydrid wurde im Labor durch Reaktion zwischen geschmolzenem Lithiummetall und Wasserstoffgas bei einer Temperatur von 973 K (700 ° C) erhalten.
2 li + h2 → 2 Lih
Es werden gute Ergebnisse erzielt, wenn die exponierte Oberfläche des geschmolzenen Lithiums erhöht wird und die LIH -Sedimentationszeit verringert wird. Es ist eine exotherme Reaktion.
Ich benutze als Schutzschild gegen gefährliche Strahlung
LIH präsentiert eine Reihe von Merkmalen, die es attraktiv machen, als Schutz für Menschen in Kernreaktoren und Weltraumsystemen als Schutz verwendet zu werden. Hier sind einige dieser Eigenschaften:
- Es hat einen hohen Wasserstoffgehalt (12,68 % nach Gewicht von H) und eine hohe Anzahl von Wasserstoffatomen pro Volumeneinheit (5,85 x 10)22 H/cm -Atome3).
- Sein hoher Schmelzpunkt ermöglicht es ihm, in Hochtemperaturumgebungen ohne Gründung verwendet zu werden.
- Es hat einen niedrigen Dissoziationsdruck (~ 20 Torr an seinem Schmelzpunkt), wodurch das Material gegossen und gefroren werden kann, ohne sich unter niedrigem Wasserstoffdruck zu verschlechtern.
- Es hat eine niedrige Dichte, die es attraktiv macht, in Weltraumsystemen verwendet zu werden.
- Ihre Nachteile sind jedoch ihre niedrige thermische Leitfähigkeit und schlechte mechanische Eigenschaften. Dies hat seine Anwendbarkeit jedoch nicht verringert.
- Lih -Teile, die als Schilde dienen. Obwohl diese letzte Form bevorzugt wird.
- Bei Raumtemperatur sind die Teile vor Wasser- und Wasserdampf geschützt.
- In Kernreaktoren
In Kernreaktoren gibt es zwei Strahlungsarten:
Kann Ihnen dienen: Säuren und Basen im Alltag: Reaktionen, Verwendungen, BeispieleDirekte ionisierende Strahlung
Sie sind stark Energiepartikel, die elektrische Ladung tragen, wie z. B. Alpha (α) und Beta (β) und Protonenpartikel. Diese Strahlungsarten interagieren sehr stark mit den Materialien der Schilde und verursachen Ionisierung, wenn sie mit den Elektronen der Materialien der Materialien, durch die sie passieren, interagieren.
Indirekt ionisierende Strahlung
Es handelt sich.
 Symbol zur Warnung vor gefährlicher Strahlung. IAEA & ISO [Public Domain]. Quelle: Wikimedia Commons.
Symbol zur Warnung vor gefährlicher Strahlung. IAEA & ISO [Public Domain]. Quelle: Wikimedia Commons. Nach einigen Quellen schützt LIH Materialien und Menschen gegen diese Art von Strahlung wirksam.
- In nuklearen thermischen Antriebsraumsystemen
LIH wurde kürzlich als potenzieller Moderator und Schutzmaterial gegen Kernstrahlung für Kernthermieantriebssysteme von Raumfahrzeugen für sehr lange Reisen ausgewählt.
 Künstlerische Darstellung des Weltraumfahrzeugs mit nuklearen Antrieb im Marsumlaufbahn. NASA/SAIC/PAT RAWLINGING [Public Domain]. Quelle: Wikimedia Commons.
Künstlerische Darstellung des Weltraumfahrzeugs mit nuklearen Antrieb im Marsumlaufbahn. NASA/SAIC/PAT RAWLINGING [Public Domain]. Quelle: Wikimedia Commons. Seine geringe Dichte und sein hoher Wasserstoffgehalt bewirken, dass die Masse und das Volumen des Kernantriebsreaktors wirksam reduziert werden.
- Im Schutz gegen kosmische Strahlung
Die Exposition gegenüber Raumstrahlung ist das wichtigste Risiko der menschlichen Gesundheit bei zukünftigen interplanetären Explorationsmissionen.
Im Tiefenraum werden Astronauten dem vollständigen Spektrum von galaktischen kosmischen Strahlen (Hochenergieionen) und Solarteilchenausschließungsereignissen (Protonen) ausgesetzt sein.
Die Gefahr einer Strahlenexposition ist aufgrund der Dauer der Missionen verschlimmert. Darüber hinaus muss der Schutz der Orte, an denen Entdecker.
 Zukünftige Lebensraumsimulation auf Planet Mars. NASA [Public Domain]. Quelle: Wikimedia Commons.
Zukünftige Lebensraumsimulation auf Planet Mars. NASA [Public Domain]. Quelle: Wikimedia Commons. In dieser Reihenfolge der Ideen ergab eine Studie im Jahr 2018, dass LiH unter den bewährten Materialien die höchste Strahlungsreduzierung pro Gramm pro cm liefert2, Somit einer der besten Kandidaten für den Schutz vor kosmischer Strahlung ist. Diese Studien müssen jedoch vertieft werden.
Ich benutze als Mittel zur Lagerung und sicherem Wasserstofftransport
Energie von H erhalten2 Es ist etwas, das seit mehreren Zehn Jahren untersucht wurde und bereits angewendet wurde, fossile Brennstoffe in Transportfahrzeugen zu ersetzen.
Kann Ihnen dienen: Chemisches Gleichgewicht: Erklärung, Faktoren, Typen, BeispieleDie h2 Es kann in Brennstoffzellen verwendet werden und zur Verringerung der CO -Produktion beitragen2 und nichtX, So vermeiden Sie den Gewächshauseffekt und die Verschmutzung. Ein effektives System zum Speichern und Transport von H wurde jedoch noch nicht gefunden2 Sicherlich mit leichtem, kompaktem oder kleinem Gewicht, das es schnell ausführt und das h freigibt2 ebenso schnell.
Lih Lithiumhydrid stammt von alkalischen Hydrors, die die höchste Lagerkapazität von H haben2 (12,7 % nach Gewicht von H). Freigabe h2 durch Hydrolyse gemäß der folgenden Reaktion:
Lih + H2O → lioh + h2
Die LIH liefert 0,254 kg Wasserstoff für jede kg LIH. Darüber hinaus verfügt es über eine hohe Speicherkapazität pro Volumeneinheit, was bedeutet, dass es leicht ist und ein kompaktes Medium für H -Speicher ist2.
 Motorrad, dessen Brennstoff Wasserstoff in Form eines metallischen Hydrids wie Lih gespeichert ist. ODER.S. DOE energieeffizient und erneuerbare Energien (USA) [Öffentlichkeitsbereich]. Quelle: Wikimedia Commons.
Motorrad, dessen Brennstoff Wasserstoff in Form eines metallischen Hydrids wie Lih gespeichert ist. ODER.S. DOE energieeffizient und erneuerbare Energien (USA) [Öffentlichkeitsbereich]. Quelle: Wikimedia Commons. Darüber hinaus wird LIH leichter gebildet als andere alkalische Metallhydrors und bei Umwelttemperaturen und Drücken chemisch stabil. LIH kann vom Hersteller oder Lieferanten zum Benutzer transportiert werden. Dann durch Hydrolyse des LiH der H erzeugt2 Und das wird sicher verwendet.
Lioh Lithium -Hydroxid kann an den Lieferanten zurückgegeben werden, der Lithium durch Elektrolyse regeneriert, und dann erneut lih produziert werden.
Das LIH wurde auch erfolgreich untersucht, um zusammen mit dem fetten Hydraccin für denselben Zweck verwendet zu werden.
Verwendung bei chemischen Reaktionen
LIH ermöglicht eine komplexe Hydrors -Synthese.
Es dient zum Beispiel zur Herstellung von Lithium -Triethylborborhydrid ist ein starkes Nucleophil bei organischen Haluros -Verschiebungsreaktionen.
Verweise
- Sato und. Und Takeda oder. (2013). Wasserstoffspeicher- und Transportsystem durch Lithiumhydrid unter Verwendung von geschmolzener Salztechnologie. In geschmolzenen Salzen Chemie. Kapitel 22, Seiten 451-470. Von Scientedirect erholt.com.
- ODER.S. Nationalbibliothek für Medizin. (2019). Lithiumhydrid. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung.
- Wang, l. et al. (2019). Untersuchung über die Auswirkungen des Themal-Kernel-Effekts von Lichiumhydrid auf den Reaktiv des Kernes. Annalen der Kernenergie 128 (2019) 24-32. Von Scientedirect erholt.com.
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Giraudo, m. et al. (2018). Beschleunigungsbasierte Tests der Abschirmung der Effektivität verschiedener Materialien und Multi-Jährer unter Verwendung von leichten und schweren Ionen. Strahlungsforschung 190; 526-537 (2018). NCBI erholte sich.NLM.NIH.Regierung.
- Welch, f.H. (1974). Lithiumhydrid: Ein Raum des Weltraumalters abgeschirmt. Nukleartechnik und Design 26, 3, Februar 1974, Seiten 444-460. Von Scientedirect erholt.com.
- Simnad, m.T.(2001). Kernreaktoren: Abschirmmaterialien. In Encyclopedia of Materials: Wissenschaft und Technologie (zweite Ausgabe). Seiten 6377-6384. Von Scientedirect erholt.com.
- Hügy, t. et al. (2009). Hydrazinboran: ein vielversprechendes Wasserstoffspeichermaterial. J. BIN. Chem. SOC. 2009, 131, 7444-7446. Aus Pubs geborgen.ACS.Org.
- « Amenadiel Bedeutung, Präsenz in der Bibel und Luzifer
- Maya -Medizingeschichte, Gott, Pflanzen, Krankheiten »

