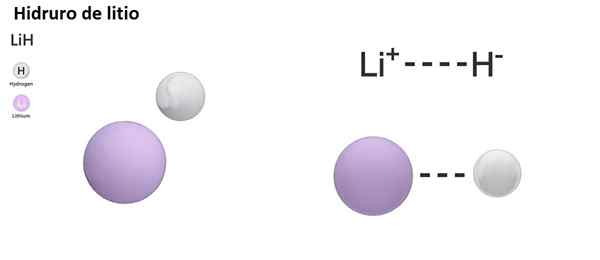Hydrors
- 746
- 140
- Joe Hartwig
Was sind Hydrouros?
Hydros sind chemische Verbindungen, die sich aus der Reaktion von Wasserstoff mit Metallelementen ergeben (Natrium, Kalium, Kalzium usw.) und nicht Metalle (Chlor, Fluor, Sauerstoff, Stickstoff, Kohlenstoff usw.). Wasserstoff reagiert mit fast allen chemischen Elementen, sodass Hydrors sehr unterschiedliche Substanzen sind.
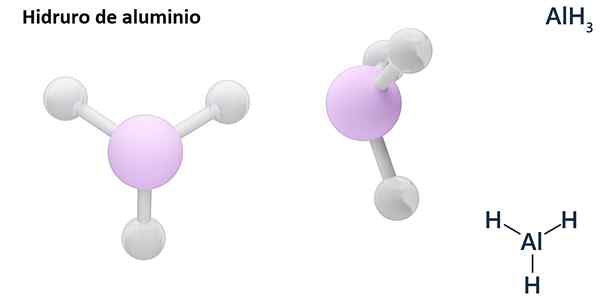
Seine allgemeinen Formeln können der MH -Typ seinN, Wo m Metall ist und N seine Valencia (+1, +2, +3), wie Aluminiumhydrid, Alh3; oder vom EH -TypN oder hNUnd wo E ein nicht -metallisches Element ist und N Seine Valencia, wie NH3 oder h2S.
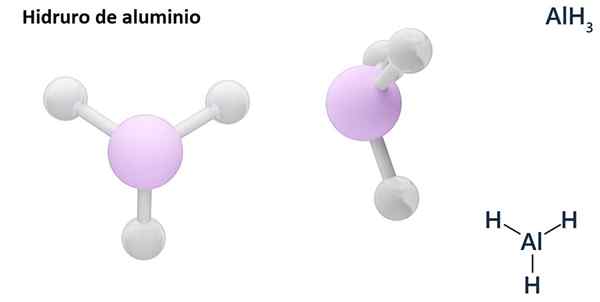
Hydros sind normalerweise binäre Verbindungen, dh sie resultieren aus der Kombination von Wasserstoff mit einem anderen chemischen Element. Wasserstoff kann jedoch auch Kombinationen mit mehreren chemischen Elementen herstellen, um komplexere Hydrors zu bilden. Alle erklärten Hydrors werden binär sein, wie z. B. ALH3 und Nein.
Es gibt drei Arten von Hydrors gemäß der Art seiner chemischen Bindung: ionisch, molekular und metallisch. Ionische oder Salzhydrors sind durch das Vorhandensein einer ionischen Bindung gekennzeichnet. Diese Verbindung besteht aus der elektrischen Anziehungskraft zwischen der positiven Belastung eines alkalischen Metalls (NA+) oder alkalisch-bundle (mg2+) und die negative Belastung von Hydridanion (H)-).
Molekulare Hydride hingegen sind durch die Bildung einer kovalenten Bindung zwischen Wasserstoff und einem nicht -metallischen Element gekennzeichnet. Unter den nicht -metallischen Elementen, die Hydros bilden.
Und Metallhydrors resultieren aus der Kombination von Wasserstoff mit einigen Übergangsmetallen. Diese Art von Hydriden hat im Gegensatz zu den vorherigen komplexen Strukturen und wird hier nicht erklärt.
Hydroseigenschaften
Die Eigenschaften von Hydrehen variieren je nach Art des Hydrids: ionisch, molekular oder metallisch, sodass ihre Eigenschaften getrennt angezeigt werden müssen.
Ionische oder Salzhydrors
Sie sind kristalline weiße Feststoffe, aber aufgrund des Vorhandenseins von Verunreinigungen erwerben sie eine graue Farbe. Diese Hydride sind nicht löslich in gemeinsamen Lösungsmitteln wie Wasser, Alkohol usw. Sie haben auch hohe Siede- und Fusionspunkte.
Sie haben eine hohe und geschmolzene Zustandsdichte können Strom leiten.
Ionenhydurns gelten als basisch oder alkalisch, da Wasser in Wasser aushydroxiden gelöst und molekulare Wasserstoff freigesetzt wird:
NaH +h2O → h2 + Naoh
Die Reaktion des ionischen Hydrids mit Wasser ist sehr kräftig und gefährlich: Es erzeugt Wasserstoff in einer Gasform, was ein brennbares und brennbares Material ist.
Ionenhydurns können auch mit Metallhalogeniden reagieren, die durch ein Metall und ein nicht -metaler bekanntes als Halogen bekannt sind (MX, X = F, Cl, Br, I):
Kann Ihnen dienen: Dimethylanylin: Struktur, Eigenschaften, Synthese, verwendet4 lih +alcl3 → lialh4 + 3 licl
Lih (Lithiumhydrid) ist eine binäre Verbindung; Während der Lialh4 (Lithium und Aluminiumhydrid) ist eine ternäre Verbindung, dh es besteht aus drei chemischen Elementen.
Molekulare oder kovalente Hydros
Sie sind im Gegensatz zu ionischen Hydrors im flüssigen oder gasförmigen Zustand, die fest sind. Sie haben niedrige Siede- und Fusionspunkte und beobachten, dass durch Erhöhen des Molekulargewichts von Hydrid der Siedepunkt zunimmt. Außer Ammoniak (NH3), Wasser (h2O) und Fluoridhydrid (HF).
Kovalente Hydride sind schlechte Stromleiter und viele ihrer Eigenschaften sind auf die Bildung von Wasserstoffbrücken zurückzuführen. Kovalente Hydride werden als Säuren angesehen, da in Wasser gelöst.
Metallhydrors
Sie sind im festen Zustand und präsentieren den dunklen Ton der Metalle. Sie sind gute Stromleiter und haben glänzende Oberflächen. Metallische Hydride, die in der Luft stabil sind3) Präsentieren Sie diese Eigenschaft.
Nomenklatur
Der Weg, Hydrors zu nennen, ist einfach und variiert in keiner der Nomenklaturen zu sehr. Wenn das metallische Metall oder Element mehr als eine Valenz aufweist, ist es in Klammern und mit römischer Anzahl gemäß der Aktiennomenklatur festgelegt.
Zum Beispiel die FEH3 wird als Eisenhydrid (III) und COH bezeichnet2 Kobalthydro (II). Dieselben Hydride können auch mit der systematischen Nomenklatur ernannt werden, die die griechischen Zahlen nutzt (DI, Tri, Tetra usw.). So der FEH3 wird als Eisen -Trihydrid bezeichnet, und COH2 Kobalt Dihydruro.
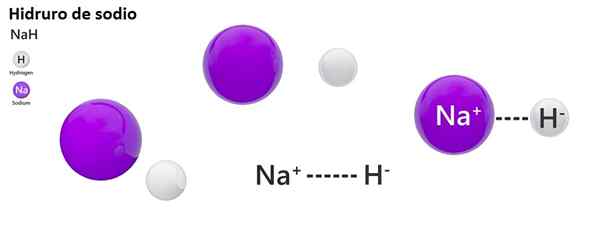
Die klassische Nomenklatur wird für Hydro nicht häufig verwendet. Zum Beispiel ist NaH eher als Natriumhydrid und nicht als Natriumhydrid bekannt.
 Natriumhydrid
Natriumhydrid Wie werden Hydros gebildet??
Ionische oder Salzhydrors
Sie werden durch die Reaktion von Wasserstoff mit einem Metall zur Gruppe alkalischer Metalle oder der Gruppe von alkalisch-terrero-Metallen gebildet.
In Hydrors, die mit diesen Metallen ausgebildet sind, befindet sich Wasserstoff in der H -Form-, bekannt als Hydridanion.
Alkalische Metalle (Lithium, Natrium, Kalium, Rubidium und Cäsium) reagieren mit Wasserstoff, um ihre entsprechenden Hydurns zu bilden:
2 m (l)+h2(g) → 2mh (s)
Kann Ihnen dienen: EinheitenoperationenMetall M beim Reagieren befindet sich in einem flüssigen Zustand und Wasserstoff im gasförmigen Zustand, sodass die Reaktion hohe Temperaturen und hohe Drücke erfordert. Betrachten Sie das folgende Beispiel:
2 li (l) +h2 (g) → 2 Lih (s)
Die Reaktion von Wasserstoff mit alkalisch-drittlichen Metallen (Beryllium, Magnesium, Calcium, Strontium und Barium) für die Hydridbildung ähnelt denen, die mit alkalischen Metallen beobachtet wurden.
Magnesium- und Beryllium bilden hydroide, aber ihre Bindungen mit Wasserstoff sind vom kovalenten Typ; Das heißt, nicht -ionisch, im Gegensatz zu anderen alkalischen Metallen:
Ca (l) +h2 (g) → CAH2 (S)
Molekulare Hydrors
Wasserstoff kann mit Nicht -Metallen reagieren, die den Gruppen 14, 15, 16 und 17 der Perioden Tabelle entsprechen, um molekulare Hydrors zu bilden. Betrachten Sie beispielsweise die Bildung von Fluoridhydrid durch Kombination oder direktes Gemisch von Wasserstoff mit Fluor:
H2 (g) +f2 (g) → 2 HF (g)
HF ist eher als Wasserstofffluorid bekannt, wird aber auch als Fluoridhydrid bezeichnet.
Außerdem kann Wasserstoff nach demselben Schema mit Sauerstoff (Gruppe 16 der Periodenplatte) reagieren:
2 h2 (g) +oder2 (g) → 2 h2O (g)
Die Reaktion erfordert eine Wärmeversorgung, um Wasserstoffoxid (Wasser) oder Sauerstoffhydrid zu erzeugen.
Außerdem kann Wasserstoff mit Stickstoff reagieren, der zur Gruppe 15 der Periodenziele -Tabelle gehört, um Stickstoffhydrid zu bilden, besser bekannt als Ammoniak (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (G)
Die Reaktion erfordert Wärmeversorgung, hohen Druck und das Vorhandensein von Katalysatoren (sie beschleunigen chemische Reaktionen).
Metallhydrors
Sie werden durch die Reaktion von Übergangsmetallen (Gruppen 3, 4, 5, 6, 10, 11 und 12 des Periodenzüchttisches) mit Wasserstoff gebildet. Übergangsmetalle der Gruppen 7, 8 und 9 bilden jedoch keine Verbindungen mit Wasserstoff, einem Phänomen, das als Hydridspalt oder Lückenhydrid bekannt ist.
Ein einzigartiges Merkmal von Übergangsmetallen Hydrors ist, dass sie nicht immer einen festen Anteil zwischen der Anzahl der Wasserstoffatome und der Anzahl der in Hydrid vorhandenen Atome aufweisen. Das heißt, ihre Formeln und Strukturen sind nicht einfach darzustellen.
Verwendung/Anwendungen von Hydros
 Hydros sind in einer der vielen Arten von Batterien sehr vorhanden: wie nimh. Quelle: Multicherry, CC BY-SA 4.0, über Wikimedia Commons
Hydros sind in einer der vielen Arten von Batterien sehr vorhanden: wie nimh. Quelle: Multicherry, CC BY-SA 4.0, über Wikimedia Commons Hydros sind in Nickel -Metallic -Hydrid -Batterien (NIMH) vorhanden, die gemeinsam mit Seltenerdmetallen, Kobalt oder Mangan verwendet werden. Mehrere Metallhydrors wurden zur Verwendung in Elektroautos untersucht, die von Wasserstoffbezogenen Zellen angetrieben werden.
Kann Ihnen dienen: Redox Balance -Methode: Schritte, Beispiele, ÜbungenReduzierende Agenten
Lithiumhydrid und Natriumbor (NABH4) Sie werden als chemische Reaktionen bei organischen Synthesereaktionen verwendet.
Wasserstoffspeicher und andere verwandte Verwendungen
In Kraftfahrzeugen gibt es Piloten mit Wasserstoff als Kraftstoff, aber aufgrund ihrer Explosivität war die Verwendung als Kraftstoff begrenzt. Die Verwendung von Hydros wurde als Form der Wasserstoffspeicherung vorgeschlagen, um ihre Gefahr zu kontrollieren.
Darüber hinaus wurden Hydrors zur Reinigung und Trennung von Wasserstoff- und Temperatursensoren verwendet.
Trockenmittel
Calciumhydrid wird verwendet, um das in organische Lösungsmittel vorhandene Wasser zu entfernen.
Säuren stammen aus molekularen Hydrors
Zum Beispiel: Salzsäure wird durch die Lösung in einem wässrigen Medium Chlorhydrid (HCL) unter Verwendung von Salzsäure bei der Eliminierung von Oxiden gebildet.
Düngemittel
Das Ammoniak (NH3) Es ist ein Hydrid, das als Flüssigkeitsdünger verwendet wird und für die Synthese von Verbindungen mit Ammoniumnitrat und Ammoniumsulfat dient, die als Dünger verwendet werden.
Wasser
Ist das wichtigste Hydrid. Es wird in vielen Branchen mit unterschiedlichen Verwendungen und Anwendungen verwendet. Wasser ist die Hauptverantwortung für die Existenz von Lebewesen.
Beispiele für Hydrors
Schließlich werden andere Beispiele von Hydrors mit ihren jeweiligen Formeln und Namen aufgeführt:
SNH4: Zinnhydrid | PH3: Phosphorhydrid (Phosphin) oder Phosphor -Trihydrid |
KH: Bleihydrid | MGH2: Magnesiumhydrid oder Magnesiumdihydruro |
KH: Kaliumhydrid | CH4: Carruro Carruro oder Carbon Tetrahydrid (Methan) |
CAH2: Calciumhydrid | FEH2: Eisenhydrid (II) |
Nah: Natriumhydrid | ZnH2: Zinkhydrid |
Lih: Lithiumhydrid | BAH2: Bariumhydrid |
CSH: Cäsiumhydrid | BH3: Borhydro (Bas |
Beh2: Beryl oder Beryl Dihydridhydrid | SIH4: Silicon Hydro (Silan) |
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wojes, Ryan. (27. August 2020). Was ist ein Metallhydrid? Erholt von: thoughtco.com
- Amerikanische Elemente. (2020). Hydridide. Abgerufen von: Amerikanerungen.com
- Wikipedia. (2020). Hydrid. Abgerufen von: in.Wikipedia.Org
- Tandis Arani. (15. August 2020). Hydridide. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Hydrid. Erholt von: Britannica.com