Aluminiumhydroxidstruktur, Eigenschaften, Verwendung, Risiken
- 665
- 51
- Rieke Scheer
Er Aluminiumhydroxid Es ist eine anorganische Verbindung, deren chemische Formel bei (OH) ist3. Im Gegensatz zu anderen Metallhydroxiden handelt es sich um eine Amphotero, die je nach Medium reagieren oder sich wie eine Säure oder eine Base verhalten kann. Es ist ein ziemlich unlöslicher weißer Feststoff im Wasser, so dass es als Bestandteil von Antazida verwendet wird.
Wie der Mg (OH)2 oder die Brucita, mit der es bestimmte chemische und physikalische Eigenschaften teilt, sieht ausschließlich wie ein Amorph aus und glänzt fest; Wenn sich jedoch mit einigen Verunreinigungen kristalline Formen kristallisiert, als wären sie Perlen. Unter diesen Mineralien natürliche Quellen von AL (OH)3, ist die gibbsita.
 Spezial Gibbsita Crystal. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]
Spezial Gibbsita Crystal. Quelle: Rob Lavinsky, Irocks.com-c-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]] Zusätzlich zum Gibbsite sind Mineralien Bayerite, Nordstrandit und Doleyíta, die die vier Aluminiumhydroxidpolymorphen bilden. Strukturell sind sie einander sehr ähnlich und differenzieren sich in der Art und Weise, wie die Schichten oder Ionenblätter lokalisiert oder gekoppelt sind, sowie die Art der enthaltenen Verunreinigungen.
Kontrolle der pH- und Syntheseparameter kann jede dieser Polymorphen hergestellt werden. Ebenso können einige chemische Arten von Interesse zwischen ihren Schichten eingegrenzt werden. Dies stellt den Einsatz eines technologischen Ansatzes für AL (OH) dar3. Seine anderen Verwendungen sind wie Antazida.
Andererseits wird es als Rohstoff verwendet, um Aluminiumoxid zu erhalten, und seine Nanopartikel wurden als katalytische Unterstützung verwendet.
[TOC]
Struktur
Formel und OctAedro
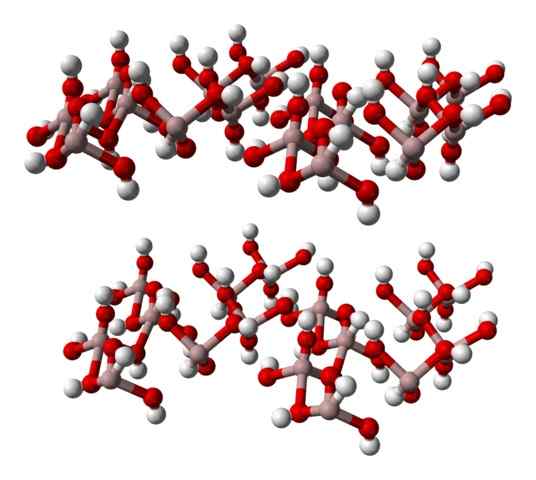
Die chemische Formel bei (OH)3 zeigt einmal die Beziehung zu3+: Oh- Es ist 1: 3; Das heißt, es gibt drei Anionen oh- für jedes Kation zu3+, Das ist dasselbe wie zu sagen, dass der dritte Teil seiner Ionen Aluminium entspricht. Also al3+ und oh- Sie interagieren elektrostatisch, bis ihre Attraktionen einen hexagonalen Kristall definieren.
Al jedoch Al3+ Es ist nicht unbedingt von drei OH umgeben- aber sechs; Daher ist die Rede von einer Koordinationsoktaeder bei (OH)6, in denen es sechs Wechselwirkungen gibt al-o. Jedes Oktaeder repräsentiert eine Einheit, mit der das Glas gebaut wird, und einige von ihnen übernehmen triklinische oder monokline Strukturen.
Das untere Bild repräsentiert teilweise die Oktaeder zu (OH)6, Da werden nur vier Wechselwirkungen beobachtet3+ (hellbraune Kugeln).
 Hexagonales Glas Gibbsite, ein Aluminiumhydroxid -Mineral. Quelle: Benjah-BMM27 [Public Domain].
Hexagonales Glas Gibbsite, ein Aluminiumhydroxid -Mineral. Quelle: Benjah-BMM27 [Public Domain]. Wenn diese Struktur sorgfältig beobachtet wird, was der des Gibbite -Minerals entspricht, kann bedenkt werden, dass die weißen Kugeln die „Gesichter“ oder Oberflächen der Ionenschichten integrieren; Dies sind die Wasserstoffatome von OH -Ionen-.
Kann Ihnen dienen: Miet -Halogenuros: Eigenschaften, erhalten, BeispieleBeachten Sie, dass es eine Schicht A und ein anderes B gibt (räumlich nicht identisch) zusammen miteinander durch Wasserstoffbrücken.
Polymorphen
Die Schichten A und B sind nicht immer auf die gleiche Weise gekoppelt, ebenso wie ihre physischen Umgebungen oder Gastionen (Salze) können sich ändern. Folglich die Kristalle von Al (OH)3 Sie variieren in vier mineralogischen Formen oder in diesem Fall polymorph.
Es wird dann gesagt, dass Aluminiumhydroxid bis zu vier Polymorphen hat: Gibbsite oder Hydragilit (monoklinisch), Bayerit (monoklinisch), Doyleíta (Tricycling) und Nordstrandit (Trichliner). Von diesen Polymorphen ist Gibbsita die stabilste und reichlichste; Die anderen werden als seltene Mineralien eingestuft.
Wenn die Kristalle im Mikroskop beobachtet würden, wäre es zu sehen, dass ihre Geometrie sechseckig ist (obwohl etwas unregelmäßig). Der pH spielt eine wichtige Rolle beim Wachstum solcher Kristalle und der daraus resultierenden Struktur; Das heißt, mit einem pH -Wert, der ein Polymorph oder eine andere Form bilden kann.
Zum Beispiel, wenn das Medium, in dem das Al (OH) ausfällt3 Es hat einen pH -Wert von weniger als 5,8 Gibbsita; Wenn der pH -Wert größer als dieser Wert ist, wird die Bayerita gebildet.
In grundlegenden Medien neigen Nordstrandita und Doyleíta -Kristalle dazu, sich zu formen. Als die am häufigsten vorkommende Gibbsite ist es eine Tatsache, die die Säure seiner Verwitterungsumgebungen widerspiegelt.
Eigenschaften
Aussehen
Weißer Feststoff, der in verschiedenen Formaten kommen kann: granuliert oder pulver und amorphes Aussehen.
Molmasse
78.00 g/mol
Dichte
2,42 g/ml
Schmelzpunkt
300 ° C. Es hat keinen Siedepunkt, da Hydroxid Wasser verliert, um sich in Aluminiumoxid oder Aluminiumoxid zu verwandeln, zu2ENTWEDER3.
Wasserlöslichkeit
1 · 10-4 G/100 ml. Seine Löslichkeit nimmt jedoch mit der Zugabe von Säuren (H3ENTWEDER+) oder alkalis (oh-).
Löslichkeitsprodukt
Ksp = 3 · 10–34
Dieser kleine Wert bedeutet, dass sich nur eine winzige Portion in Wasser auflöst:
Al (OH)3(Salz3+(AC) +3OH-(Ac)
Und in der Tat macht diese verabscheuungswürdige Löslichkeit es zu einem guten Neutralizer der Säure, da sie die Magenumgebung nicht zu stark stützt, um fast Ionen OH zu veröffentlichen-.
Anfoterismus
Der Al (OH)3 Es ist durch seinen Amphotercharakter gekennzeichnet; Das heißt, es kann reagieren oder sich verhalten, als wäre es eine Säure oder eine Base.
Zum Beispiel mit Hionen reagieren3ENTWEDER+ (Wenn das Medium wässrig ist), um den komplexen Acuo [bis (OH) zu bilden2)6]3+; was wiederum hydrolysiert werden, um die Umwelt zu säuern, daher der Al3+ ein Säureion:
Kann Ihnen dienen: Cannizzaro Reaktion: Eigenschaften, Mechanismen, BeispieleAl (OH)3(s) +3h3ENTWEDER+(ac) => [al (OH2)6]3+(Ac)
[Al (oh2)6]3+(Ac) +h2Oder (l) [al (oh2)5(Oh)]2+(Ac)+h3ENTWEDER+(Ac)
Wenn dies passiert, wird gesagt, dass Al (OH)3 Es verhält sich wie eine Basis, da es mit H reagiert3ENTWEDER+. Andererseits können Sie mit dem OH reagieren-, Verhalten wie eine Säure:
Al (OH)3(s) +oh-(ac) => ah (oh)4-(Ac)
In dieser Reaktion der weiße Niederschlag von Al (OH)3 Es löst sich bis zum Überschuss an Ionen OH auf-; Tatsache, dass dies bei anderen Hydroxiden wie Magnesium, MG (OH) nicht dasselbe geschieht2.
Der Al (OH)4-, Alumination kann es angemessener ausgedrückt werden als: [Al (OH2)2(OH)4]-, Hervorhebung der Koordinationsnummer 6 für das Kation auf3+ (Das OctAedro).
Dieses Ion kann weiter mit mehr OH reagieren- Bis zur Koordination Octaederon: [Al (OH)6]3-, Hexahidroxoaluminat -Ion genannt.
Nomenklatur
Der Name "Aluminiumhydroxid", der sich am meisten auf diese Verbindung bezieht. Der (iii) wird am Ende weggelassen, da der Aluminiumoxidationsstatus in allen Verbindungen +3 beträgt.
Die beiden anderen möglichen Namen, die sich auf AL (OH) beziehen können3 Sie sind: Aluminium -Trihydroxid gemäß der systematischen Nomenklatur und der Verwendung griechischer Zähler; und Aluminiumhydroxid, das mit dem Suffix -ICO endet, um einen einzelnen Oxidationszustand zu haben.
Obwohl im chemischen Bereich die Nomenklatur von AL (OH)3 Es stellt keine Herausforderung oder Verwirrung dar, außerhalb dessen tendenziell mit Unklarheiten gemischt werden.
Zum Beispiel ist Gibbsita Mineral eines der natürlichen Polymorphen von AL (OH)3, zu dem sie auch als γ-al (OH) nennen3 oder α-al (OH)3. Α-al (OH) jedoch3 Es kann auch dem Bayerita Mineral oder β-Al (OH) entsprechen3, Nach der kristallographischen Nomenklatur. Inzwischen werden Nordstrandita und Doyleita -Polymorphen normalerweise einfach als (OH) bezeichnet3.
Die folgende Liste fasst die neu erklärten eindeutig zusammen:
-Gibbsita: (γ oder α) -Al (OH)3
-Bayerita: (α oder β) -Al (OH)3
-Nordstrandita: Al (OH)3
-Doyleita: Al (OH)3
Anwendungen
Rohmaterial
Die sofortige Verwendung für Aluminiumhydroxid ist als Rohstoff für die Herstellung von Aluminiumoxid oder anderen Verbindungen, anorganischen oder organischen Aluminium; Zum Beispiel: Alcl3, Durch nicht3)3, Alf3 oder Naal (OH)4.
Katalytische Träger
Al (OH) Nanopartikel3 Sie können als katalytische Stützen fungieren; Das heißt, der Katalysator verbindet sich ihnen, um an ihrer Oberfläche zu fixieren, wo chemische Reaktionen beschleunigt werden.
Kann Ihnen dienen: Synthesereaktion: Typen, Faktoren, BeispieleInternationale Verbindungen
Im Strukturabschnitt wurde erklärt, dass der Al (OH)3 Es besteht aus Schichten oder Blättern A und B, gekoppelt, um einen Kristall zu definieren. Darin gibt es kleine oktaedrische Räume oder Hohlräume, die von anderen Ionen, metallischen oder organischen oder neutralen Molekülen besetzt werden können.
Wenn Kristalle aus (OH) synthetisiert werden3 Bei diesen strukturellen Modifikationen wird gesagt, dass eine Interkalationsverbindung hergestellt wird. das heißt, durchsetzt oder stecken chemische Arten zwischen den Blättern A und B. Dabei entstehen neue Materialien, die aus diesem Hydroxid hergestellt wurden.
Feuerdämmend
Der Al (OH)3 Es ist ein gutes Feuerschutzmittel, das Anwendung als Füllmaterial vieler Polymermatrizen findet. Dies liegt daran2 oder die Brucita.
Medizinisch
Der Al (OH)3 Es ist auch eine neutralisierende Säure, die mit der HCl von Magensekreten reagiert. Auch hier, ähnlich wie es mit dem MG (OH) passiert2 von Magnesia Milch.
Beide Hydroxide können in verschiedenen Antazida gemischt werden, um die Symptome von Menschen, die an Gastritis oder Magengeschwüren leiden, zu lindern.
Adsorbens
Wenn es unter seinem Schmelzpunkt erhitzt wird, wird Aluminiumhydroxid in aktivierte Aluminiumoxid (sowie Aktivkohlenstoff) umgewandelt. Dieser Feststoff wird als Adsorbens von unerwünschten Molekülen, entweder Farbstoffen, Verunreinigungen oder Verschmutzungsgasen.
Risiken
Die Risiken, die Aluminiumhydroxid darstellen können. Um es zu speichern.
Bei Antacizen, die in Apotheken erreicht werden, können unerwünschte Nebenwirkungen auftreten, wie z. B. Verstopfung und Hemmung des Darmphosphats. Auch und obwohl es keine Studien gibt, um dies zu demonstrieren, wurde es mit neurologischen Erkrankungen wie Alzheimer in Verbindung gebracht.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Hydroxidaluminium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Hydroxidaluminium. Pubchem -Datenbank. CID = 10176082. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Danielle Reid. (2019). Hydroxidaluminium: Formel & Nebenwirkungen. Lernen. Erholt von: Studium.com
- Robert Schoen & Charles und. Roberson. (1970). Strukturen von Aluminiumhydroxid und geochemischen Auswirkungen. Der amerikanische Mineralogist, Vol 55.
- Vitaly p. Isupov & col. (2000). Synthese, Struktur, Eigenschaften und Anwendung von Aluminiumhydroxid -Interkalationsverbindungen. Chemie für nachhaltige Entwicklung 8,121-127.
- Drogen. (24. März 2019). Nebenwirkungen von Aluminiumhydroxid. Erholt von: Drogen.com
- « Vanadio -Geschichte, Eigenschaften, Struktur, verwendet
- Nickelgeschichte, Eigenschaften, Struktur, Verwendungen, Risiken »

