Calciumhydroxid (CA (OH) 2) Struktur, Eigenschaften, erhalten, verwendet, verwendet

- 1313
- 215
- Rieke Scheer
Er Kalziumhydroxid Es ist eine anorganische Verbindung, deren chemische Formel CA (OH) ist2. Es ist ein weißes Pulver, das seit Tausenden von Jahren verwendet wird und in dem es mehrere traditionelle Namen oder Spitznamen gewonnen hat. Unter ihnen können wir die stumpfe, tote, chemische, hydratisierte oder feine erwähnen.
In der Natur ist es in einem wenig reichlich vorhandenen Mineral namens Portlandita erhältlich, in derselben Farbe. Aus diesem Grund die CA (OH)2 Es wird nicht direkt von diesem Mineral, sondern von einer Wärmebehandlung, gefolgt von der Flüssigkeitszufuhr, von Kalkstein erhalten. Dies wird durch Lime, CAO, erhalten, das später ausschaltet oder mit Feuchtigkeit versorgt, um die CA (OH) zu produzieren2.
 Eine feste Probe von Calciumhydroxid. Quelle: Chemicalinterust [Public Domain]
Eine feste Probe von Calciumhydroxid. Quelle: Chemicalinterust [Public Domain] Die CA (OH)2 Es ist eine relativ schwache Basis im Wasser, da es sich kaum in heißem Wasser auflösen kann. Seine Löslichkeit nimmt jedoch kaltes Wasser zu, da seine Flüssigkeitszufuhr exotherm ist. Seine Basizität ist jedoch weiterhin ein Grund, während seiner Manipulation vorsichtig mit ihr zu sein, da es überall im Körper Verbrennungen verursachen kann.
Es wurde als pH -Regulierungsbehörde für verschiedene Materialien oder Lebensmittel verwendet, sondern auch eine gute Kalziumquelle in Bezug auf seine Masse. Es verfügt über Anwendungen in der Papierindustrie, bei der Desinfektion des Abwasser.
Die wichtigste Verwendung war jedoch als Baumaterial, da Kalk beim Mischen mit den anderen Zutaten des Gips oder Mörsers hydratisiert ist. In diesen gehärteten Gemischen, CA (OH)2 Absorbieren das Kohlendioxid der Luft, um Sandkristalle zusammen mit gebildetem Calciumcarbonat zu konsolidieren.
Derzeit wird die Forschung noch mit dem Ziel durchgeführt, bessere Baumaterialien mit CA (OH) zu entwickeln2 direkt in seiner Komposition als Nanopartikel.
[TOC]
Struktur
Kristall und seine Ionen
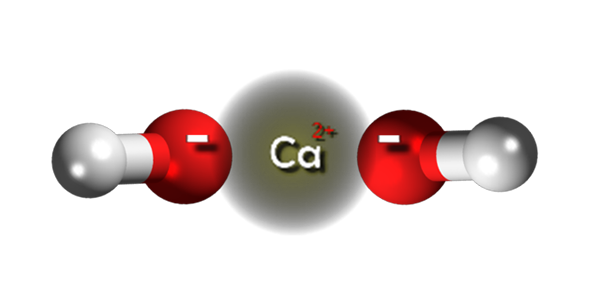 Calciumhydroxidionen. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]]
Calciumhydroxidionen. Quelle: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)]] Im oberen Bild haben wir die Ionen, die Calciumhydroxid integrieren. Seine gleiche CA -Formel (OH)2 weist darauf hin, dass für jedes Kation CA2+ Es gibt zwei OH -Anionen- das interagiert mit ihm durch elektrostatische Anziehung. Das Ergebnis ist, dass beide Ionen am Ende einen hexagonalen Strukturkristall festlegen.
In solchen hexagonalen Kristallen von CA (OH)2 Die Ionen sind sehr nahe beieinander, was das Aussehen einer polymeren Struktur verleiht; Obwohl es keine offizielle kovalente Bindung gibt, CA-O, da es immer noch den bemerkenswerten Unterschied der Elektronegativität zwischen den beiden Elementen ist.
 Calciumhydroxidstruktur
Calciumhydroxidstruktur Die Struktur erzeugt OctAedros CAO6, Das heißt, die ca2+ Interagieren Sie mit sechs OH- (AC2+-Oh-).
Es kann Ihnen dienen: Lithiumhydroxid (lioh)Eine Reihe dieser Oktaeder besteht eine Glasschicht, die mit einem anderen durch Wasserstoffbrücken interagieren kann, die sie intermolekular zusammenhängend halten; Diese Wechselwirkung verblasst jedoch bei einer Temperatur von 580 ° C, wenn die CA (OH) dehydriert ist2 nach Cao.
Auf der Seite des hohen Drucks gibt es nicht viele Informationen darüber, obwohl Studien überprüft, dass das hexagonale Glas bei einem Druck von 6 GPa einen Übergang vom sechseckigen zur monoklinischen Phase hat. Und damit die Verformung des Octaedros CAO6 und seine Schichten.
Morphologie
Die CA (OH) -Kristalle2 Sie sind sechseckig, aber das ist kein Hindernis für sie, eine Morphologie zu übernehmen. Einige dieser Strukturen (Stränge, Flocken oder Felsen) sind poröser als andere, robust oder flach, was ihre endgültigen Anwendungen direkt beeinflusst.
Daher ist es nicht dasselbe, Kristalle aus dem Portland Mineral zu verwenden, als sie so zu synthetisieren, dass sie aus Nanopartikeln bestehen, bei denen einige strenge Parameter befolgt werden; wie der Feuchtigkeitsgrad, die Konzentration des verwendeten CAO und die Zeit, die Glas wachsen ließ.
Eigenschaften
Aussehen
Feste weiße, Toilette und bitterer Geschmack fester Geschmack.
Molmasse
74.093 g/mol
Schmelzpunkt
580 ºC. Bei dieser Temperatur wird das Freisetz von Wasser abgebaut, sodass es nie dampft:
CA (OH)2 => Cao + h2ENTWEDER
Dichte
2,211 g/cm3
pH
Eine wässrige wässrige Lösung hat einen pH -Wert von 12,4 bis 25 ° C.
Wasserlöslichkeit
Die Löslichkeit von CA (OH)2 In Wasser nimmt mit zunehmendem Temperaturanstieg ab. Zum Beispiel beträgt seine Löslichkeit bei 0 ºC 1,89 g/l; Bei 20 ° C und 100 ° C sind diese 1,73 g/l bzw. 0,66 g/l.
Dies zeigt eine thermodynamische Tatsache an: CA -Hydratation (OH)2 Es ist exotherm, so dass die Gleichung dem Prinzip von Le Catelier gehorcht:
CA (OH)2 AC2+ + 2OH- + Q
Wo ist die Wärme freigelassen?. Je heißer das Wasser ist, das Gleichgewicht neigt mehr links; Das heißt, die CA (OH) löst sich weniger auf2. Aus diesem Grund löst sich in kaltem Wasser viel mehr auf als im kochenden Wasser.
Andererseits steigt diese Löslichkeit, wenn der pH -Wert saur wird, aufgrund der Neutralisation von OH -Ionen- und zur Vertreibung des vorherigen Gleichgewichts nach rechts. Während dieses Prozesses wird noch mehr Wärme freigesetzt als in neutralem Wasser. Neben sauren wässrigen Lösungen, CA (OH)2 Es ist auch in Glycerin löslich.
K$
5,5 · 10-6. Dieser Wert wird als klein angesehen und stimmt mit der geringen Löslichkeit von CA (OH) überein2 Im Wasser (das gleiche Gleichgewicht oben).
Kann Ihnen dienen: MetalleBrechungsindex
1,574
Stabilität
Die CA (OH)2 Es bleibt stabil, solange es nicht Co. ausgesetzt ist2 der Luft, da sie sie absorbiert und Calciumcarbonat bildet, Caco3. Daher beginnt es in einer festen Mischung aus Ca (OH) -Kristallen zu verstopft2-Dieb3, Wo es KO -Anionen gibt32- Wettbewerb mit OH- Mit CA zu interagieren2+:
CA (OH)2 + CO2 => Caco3 + H2ENTWEDER
Tatsächlich ist dies der Grund, warum die konzentrierten Lösungen von CA (OH)2 Sie drehen Betten, als eine Aufhängung von Caco -Partikeln erscheint3.
Erhalten
Die CA (OH)2 Es wird kommerziell durch Reagieren des Kalk CAO mit einem Überschuss von zwei- bis drei Mal Wasser erhalten:
Cao + h2O => ca (OH)2
Die Karbonisierung von CA (OH) kann jedoch dabei auftreten2, genau wie oben erläutert.
Andere Methoden zum Erhalten bestehen darin, lösliche Kalziumsalze wie den Klick zu verwenden2 oder ca (nein3)2, und stationiere sie mit Naoh, damit die CA (OH) stürzt2. Kontrolle der Parameter wie Wasser, Temperatur, pH, Lösungsmittel, Karbonisierungsgrad, Reifungzeit usw., Nanopartikel mit unterschiedlichen Morphologien können synthetisiert werden.
Es kann auch durch die Auswahl natürlicher und erneuerbarer Rohstoffmaterialien oder der Verschwendung einer Branche erstellt werden, die reich an Kalzium ist. Wenn ihre Asche erhitzt und verarbeitet wird, besteht aus Kalk; Und von hier aus kann CA (OH) wieder vorbereitet werden2 Durch Feuchtigkeit dieser Asche, ohne dass ein Kalkstein verschwenden muss, Caco3.
Zum Beispiel wurde die Bagazo del Agave für diesen Zweck verwendet, der der Verschwendung der Tequila -Industrie einen Mehrwert zuweist.
Anwendungen
Lebensmittelbehandlung
 Die Gurken werden zuerst in Calciumhydroxid eingeweicht, um knuspriger zu sein. Quelle: Pixabay.
Die Gurken werden zuerst in Calciumhydroxid eingeweicht, um knuspriger zu sein. Quelle: Pixabay. Calciumhydroxid ist in vielen Lebensmitteln in einigen seiner Zubereitungsstadien vorhanden. Zum Beispiel werden in einer wässrigen Lösung die Gurken wie Gurken eingetaucht, um sie beim Verpacken von Essig knuspriger zu machen. Dies liegt daran, dass die Proteine ihrer Oberfläche Kalzium in der Mitte absorbieren.
In ähnlicher Weise tritt es bei Maiskörnern auf, bevor sie sie in Mehl verwandelt, weil es hilft, Vitamin B freizusetzen3 (Niacina) und erleichtert sein Schleifen. Das von ihm bereitgestellte Kalzium wird auch verwendet, um bestimmten Säften einen Ernährungswert zu verleihen.
Die CA (OH)2 Sie können auch Backpulver in einigen Brotrezepten ersetzen und die Zuckerlösungen aus Zuckerrohr und Rüben klären.
Abwasser Desinfektionsmittel
Klarheit von CA (OH)2 Es ist, weil es als flockiger Mittel wirkt; Das heißt.
Kann Ihnen dienen: Pauling ScaleDiese Eigenschaft wurde verwendet, um das Abwasser zu desinfizieren und ihre unangenehmen Kolloide im Blick (und Geruch) der Zuschauer zu destabilisieren.
Papierindustrie
Die CA (OH)2 Es wird im Kraftprozess verwendet, um den zur Behandlung von Holz verwendeten NaOH zu regenerieren.
Gasabsorption
Die CA (OH)2 Es wird verwendet, um CO zu beseitigen2 von geschlossenen Räumen oder in Umgebungen, in denen ihre Anwesenheit kontraproduktiv ist.
Körperpflege
In Formulierungen für Depilatory Cremes die CA (OH)2 Es ist stillschweigend, weil seine Basizität bei der Schwächung des Keratins der Haare hilft, und daher ist es einfacher, sie zu entfernen.
Konstruktion
 Calciumhydroxid ist Teil der Strukturen alter Bauwerke wie den Pyramiden Ägyptens. Quelle: Pexels.
Calciumhydroxid ist Teil der Strukturen alter Bauwerke wie den Pyramiden Ägyptens. Quelle: Pexels. Die CA (OH)2 Er ist seit jeher anwesend, um die Massen von Gips- und Mörser integrieren, die für den Bau ägyptischer architektonischer Werke wie Pyramiden verwendet wurden. Auch Gebäude, Mausoleen, Wände, Treppen, Böden, Stützen und sogar den Wiederaufbau des Zahnzements.
Seine Befestigungsmaßnahme beruht auf der Tatsache, dass durch "Atmen" des CO "atmen" wird2, Die aus Caco resultierenden Kristalle3 Der Sand und andere Komponenten solcher Gemische enden zu einem besseren Grad.
Risiken und Nebenwirkungen
Die CA (OH)2 Es ist kein stark grundlegender Feststoff im Vergleich zu anderen Hydroxiden, obwohl mehr als das MG (OH)2. Trotzdem ist seine Basizität, obwohl sie nicht reaktiv oder brennbar ist, immer noch aggressiv genug, um leichte Verbrennungen zu verursachen.
Daher muss es mit Respekt manipuliert werden, da es in der Lage ist, Augen, Zunge und Lunge zu reizen, zusätzlich zu anderen Krankheiten wie: Verlust des Sehverlusts, schwerer Alkalinisierung von Blut, Hautausschlägen, Erbrechen und Halsschmerzen.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid Calcium. Abgerufen von: in.Wikipedia.Org
- Chávez Guerrero et al. (2016). Synthese und Charakterisierung von Calciumhydroxid aus Agavenbagasse und Erforschung seiner antibakteriellen Aktivität. Erholt von: Scielo.Org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Kristallstruktur der Hochdruckphase des Calciumhydroxids, Portlandit: Auf situ-Pulver und Einzelkristall-Röntgen-Differaktionsstudie. Amerikanischer Mineralogist; 98 (8-9): 1421-1428. Doi: doi.org/10.2138/Am.2013.4386
- Hans Lockeinger. (5. Juni 2019). Hydroxid Calcium. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Aniruddha s. et al. (2015). Synthese des Nano -Calciumhydroxids im Affliction -Medium. Die American Ceramic Society. doi.org/10.1111/Jace.14023
- Carly Vandergrindt. (12. April 2018). Wie wird Calciumhydroxid in Lebensmitteln verwendet und ist es sicher? Erholt von: Gesundheitslinie.com
- Brian Clegg. (26. Mai 2015). Hydroxid Calcium. Erholt von: Chemistryworld.com
- « Merkmale und Beispiele für chemische Phänomene
- Mesohyppus -Eigenschaften, Spezies, Reproduktion, Ernährung »

