Chromhydroxidstruktur, Eigenschaften, Synthese, verwendet

- 745
- 105
- Frederike Birkemeyer
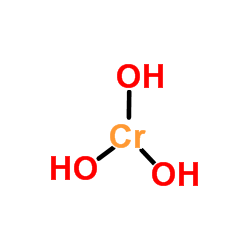
Er Chromhydroxid Es ist ein anorganisches Verbindungsprodukt der Reaktion einer Base mit einem Chromsalz. Die chemische Formel variiert je nach den Chromoxidationsstatus (+2 oder +3 für diese Art von Verbindung). So haben Cr (OH)2 Für Chromhydroxid (II) und CR (OH)3 Für Chromhydroxid (III).
Aus elektronischen Gründen die Cr2+ ist instabiler als die Cr3+, Also Cr (OH)2 Es ist ein Reduktionsmittel (verliert ein Elektron, um sich auf +3 zu bewegen). Obwohl beide Hydroxide als Niederschläge erhalten werden können, ist die CR (OH)3 -Auch als Chromhydroxid bezeichnet- ist die vorherrschende Verbindung.
 Chromhydroxid -Aussehen
Chromhydroxid -Aussehen Im Gegensatz zu den Hydroxiden, die durch die einfache Auflösung von Metalloxiden in Wasser erhalten wurden, CR (OH)3 Es wird aufgrund der schlechten Löslichkeit von Chromoxid (CR2ENTWEDER3, oberes Bild). Jedoch CR (OH)3 Es wird als Cr betrachtet2ENTWEDER3· Xh2Oder als smaragdgrünes Pigment (Guinet Green) verwendet.
Im Labor basiert es auf dem metallischen Chrom, das für die Bildung des Komplexes in Säurelösung gelöst ist [CR (OH)2)6]3+. Dieser wässrige Komplex reagiert dann mit einer Basis (NaOH oder KOH), um das entsprechende Chromhydroxid zu bilden.
Wenn die vorherigen Schritte unter Bedingungen durchgeführt werden, die das Fehlen von Sauerstoff sicherstellen, entsteht die Reaktion CR (OH)2 (Chromes Hydroxid). Anschließend ist eine Trennung und Dehydration des Niederschlagsfestes erforderlich. Infolgedessen wird der wahre CR (OH) "geboren"3, Ein grünes Pulver mit einer polymeren und unsicheren Struktur.
[TOC]
Chromhydroxidstruktur
Das obere Bild ist die einfachste Darstellung von CR (OH)3 in Gas und isolierter Phase. Auch und die Annahme des rein ionischen Charakters seiner Wechselwirkungen kann in den festen Kationen sichtbar gemacht werden3+ mit einer dreifachen Menge von OH -Anionen interagieren-.
Kann Ihnen dienen: molar absorbierendDie Art der CR-OH-Verbindung ist jedoch aufgrund der CR-Koordinationschemie kovalenterer3+.
Zum Beispiel der Komplex [Cr (OH2)6]3+ Es zeigt an, dass das metallische Chromzentrum mit sechs Wassermolekülen koordiniert ist; Da diese neutral sind, weist der Komplex die positive Belastung des ursprünglichen Kation auf, Cr, CR3+.
Oktaeder und Polymerisation
Im oberen Bild wird die Struktur des Komplexes [CR (OH "dargestellt2)6]3+. Clionen- Sie können zum Beispiel aus Salzsäure aus Salz oder Chromoxid aus stammen, wenn sie zur Auflösung von Salz oder Chrom verwendet wurde.
Wenn das Reaktionsmedium Naoh (oder Koh) zugesetzt wird, ist das OH -Ion- UN -ein Molekül dieses Komplexes, bildend [Cr (OH)2)5(Oh)]2+ (Jetzt gibt es fünf Wassermoleküle, weil der sechste einen Proton verloren hat).
Nach Anbietung dieser neuen Dehydratkomplex für einen anderen wässrigen Komplex erzeugt Dímeros, die durch Hydroxidbrücken vereint sind:
(H2ENTWEDER)5Cr-oh-cr (oh2)5
Mit zunehmender Basizität des Mediums (der pH steigt) den Komplex [CR (OH)2)4(OH)2]+, und erhöhen Sie auch die Wahrscheinlichkeiten neuer Hydroxidbrücken, Jelly -Polymere zu erstellen. Tatsächlich weigert sich dieses "grau -grün -Gelee", ordentlich ausfällt.
Schließlich Cr (oh2)3(OH)3 Es besteht aus einem Oktaeder mit der Cr3+ In der Mitte und mit drei Wassermolekülen und drei Oh verbunden- das neutralisiert ihre positive Ladung; Dies ohne Berücksichtigung der Polymerisation.
Wenn die Cr (oh2)3(OH)3 Es ist dehydriert, das koordinierte Wasser mit der CR wird beseitigt3+, Und da dieses Kation mit sechs Arten (Liganden) koordiniert wird, entstehen polymere Strukturen, in denen CR-CR-Verbindungen beteiligt sind.
Kann Ihnen dienen: Butchrisches Fett: Erhalten, Typen, Zusammensetzung, Verwendungsmöglichkeiten, VorteileAuch wenn dehydriert, kann seine Struktur eines CR -Typs berücksichtigt werden2ENTWEDER3· 3h2ENTWEDER; Mit anderen Worten, das von tri-hydratisiertem Chromoxid. Es sind jedoch die physikalisch -chemischen Untersuchungen des Festkörpers, der Licht auf die wahre Struktur von CR (OH) beleuchten kann3 in diesem Punkt.
Physikalische und chemische Eigenschaften von Chromhydroxid
Cr (OH)3 Es sieht aus wie ein blaugrünes Pulver, aber wenn es mit Wasser in Kontakt kommt, bildet es ein graugrünes Gelee.
Es ist unlöslich im Wasser, aber löslich in Säuren und starken Basen. Außerdem bricht es beim Erhitzen zusammen, wodurch Chromoxiddämpfe erzeugt werden.
Anfoterismus
Warum ist Chromhydroxid in Säure- und Basislösungen löslich? Der Grund ist der Amphoter -Charakter, der es Ihnen ermöglicht, sowohl mit Säuren als auch mit Basen zu reagieren. Diese Eigenschaft ist charakteristisch für CR3+.
Bei der Reaktion mit Säuren, CR (OH2)3(OH)3 Es wird gelöst, weil die Hydroxylbrücken gebrochen sind, verantwortlich für die Qualfrau des Niederschlags.
Andererseits, wenn mehr Basis hinzugefügt wird, oh- Sie ersetzen weiterhin die Wassermoleküle und bilden den negativen Komplex [CR (OH)2)2(OH)4]-. Dieser Komplex dreht die Lösung einer hellgrünen Farbe, die sich im Laufe der Reaktion intensiviert.
Wenn alles Cr (oh2)3(OH)3 Sie haben reagiert, ein letzter Komplex wird erhalten, wie durch die chemische Gleichung angezeigt:
Cr (oh2)3(OH)3 + 3 Oh- [Cr (OH)6] 3- + 3 h2ENTWEDER
Dieser negative Komplex ist mit umgebenden Kationen verbunden (NA+, Wenn die Basis NaOH ist) und nach der Verdunstung von Wasser das Natriumchromito -Salz (Nakro2, Smaragdgrüne Farbe). Somit können sowohl das Säure als auch das Basismedium Chromhydroxid auflösen.
Kann dir dienen: indischSynthese von Chromhydroxid im industriellen Bereich
In der Industrie wird es durch Chromsulfatausfällung mit Natrium- oder Hydroxidhydroxidlösungen erzeugt. Ebenso wird Chromhydroxid durch schematisierte Reaktion erzeugt:
Cro72- + 3 Also2 + 2H+ => 2 Cr3+ + 3 Also42- + H2ENTWEDER
Cr3+ + 3OH- => Cr (OH)3
Wie im vorherigen Verfahren gezeigt, hat die Chromreduktion VI auf Chrom III eine große ökologische Bedeutung.
Chrom III ist für Biota relativ harmlos, während Chrom VI. Neben sehr löslichem Umwelt toxisch und krebserregend ist. Daher ist die Umwelt von Bedeutung.
Die Wasser- und Bodenbehandlungstechnologie umfasst eine Verringerung von CR (VI) auf CR (III).
Anwendungen
Chromhydroxid hat verschiedene Anwendungen:
- Make -up -Formulierung.
- Haartönungen.
- Nagelpolitur.
- Hautpflegeprodukte.
- Reinigungsmittel.
- Im Metallfinish, der 73 % seines Verbrauchs in der Branche entspricht.
- In der Erhaltung von Holz.
Verweise
- Whitten, Davis, Peck & Stanley. Chemie. (8. Aufl.). Cengage Learning, S. 873, 874.
- Pubchem. Chromhydroxid. Aus Pubchem geborgen.NCBI.NLM.NIH.Regierung
- Synthese, Charakterisierung und Stabilität von Cr (III) und Fe (III) Hydroxiden. Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, e. und Antipas, G. J. Hazard Mater. 264: 490-497.
- Prebchem. Herstellung von Chrom (III) Hydroxid. Aus dem Imprimchem geborgen.com
- Wikipedia. (2018). Chrom (iii) Hydroxid. Abgerufen von.Wikipedia.Org