Quecksilberhydroxidstruktur, Eigenschaften, Verwendungen, Risiken
- 1706
- 255
- Rieke Scheer
Er Quecksilberhydroxid Es ist eine anorganische Verbindung, bei der das Quecksilbermetall (HG) eine Oxidationszahl von 2 hat+. Seine chemische Formel ist HG (OH)2. Diese Art wurde jedoch unter normalen Bedingungen noch nicht in fester Form erhalten.
Quecksilber- oder Mercuric -Hydroxidhydroxid ist ein vorübergehender Vermittler mit kurzer Lebensdauer bei der Bildung des HGO -Mercuricoxids in alkalischer Lösung. Für Studien, die in HGO -Mercuricoxid -Lösungen durchgeführt wurden, wurde abgeleitet, dass HG (OH)2 Es ist eine schwache Basis. Andere Arten, die es begleiten, sind hgoh+ und der Hg2+.
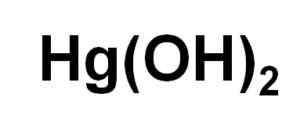 Chemische Formel von Quecksilberhydroxid (II). Autor: Marilú Stea.
Chemische Formel von Quecksilberhydroxid (II). Autor: Marilú Stea. Obwohl HG (OH) nicht in wässriger Lösung ausgefällt werden kann, ist es nicht in der Lage, in wässriger Lösung ausgefällt werden zu können2 Es wurde durch photochemische Reaktion von Quecksilber mit Wasserstoff und Sauerstoff bei sehr niedrigen Temperaturen erhalten. Es wurde auch in Form eines Coprecipited zusammen mit dem Glauben (OH) erhalten3, wo das Vorhandensein von Haluroionen Einfluss auf den pH -Wert ausübt, bei dem eine Koprezipitation auftritt.
Da es auf Laborebene nicht leicht gewonnen hat, war es nicht möglich, einen Nutzen für diese Verbindung zu finden oder die Risiken seiner Verwendung zu bestimmen. Es kann jedoch abgeleitet werden, dass es die gleichen Risiken darstellt wie die anderen Quecksilberverbindungen.
[TOC]
Molekula -Struktur
Die Struktur von Quecksilberhydroxid (ii) Hg (OH)2 Es basiert auf einem linearen zentralen Teil des Quecksilberatoms mit den beiden Sauerstoffatomen an den Seiten.
Die Wasserstoffatome sind mit dieser zentralen Struktur neben jedem Sauerstoff vereint, der sich frei um jeden Sauerstoff dreht. Es könnte auf einfache Weise wie unten angegeben dargestellt werden:
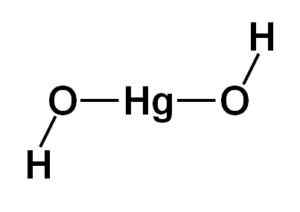 Theoretische Struktur des Quecksilberhydroxids (II). Autor: Marilú Stea
Theoretische Struktur des Quecksilberhydroxids (II). Autor: Marilú Stea Elektronische Konfiguration
Die elektronische Struktur des metallischen Quecksilbers Hg lautet wie folgt:
[Xe] 5D10 6S2
wobei [XE] die elektronische Konfiguration von edler Gas Xenon ist.
Bei der Beobachtung dieser elektronischen Struktur wird abgeleitet, dass der stabilste Oxidationszustand des Quecksilbers derjenige ist, in dem die 2 Elektronen der Schicht 6 verloren gehenS.
In HG (OH) Mercuric Hydroxid2, Quecksilberatom (HG) findet sich in seinem Oxidationszustand 2+. Daher in der Hg (OH)2 Quecksilber hat die folgende elektronische Konfiguration:
Es kann Ihnen dienen: 30 Verwendung von Carboxsäuren im Alltag[Xe] 5D10
Nomenklatur
- Quecksilberhydroxid (II)
- Mercuric Hydroxid
- Quecksilberdihydroxid
Eigenschaften
Molekulargewicht
236,62 g/mol
Chemische Eigenschaften
Nach den konsultierten Informationen ist es möglich, dass HG (OH)2 Eine vorübergehende Verbindung bei der Bildung von HGO in alkalischem wässrigem Medium sein.
Die Zugabe von Hydroxylionen (OH-) zu einer wässrigen Lösung mit Mercuric Ions Hg2+ Es führt zur Ausfällung eines gelben massiven Quecksilberoxids (II) HGO, von dem Hg (OH)2 Es ist ein Passagier oder ein temporärer Agent.
 Quecksilberoxid (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons.
Quecksilberoxid (II). Leiem [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)]]. Quelle: Wikipedia Commons. In wässriger Lösung das HG (OH)2 Es ist ein sehr kurzer Lebensvermittler, weil es schnell ein Wassermolekül freigibt und das feste Hgo ausfällt.
Obwohl es nicht möglich war, den Mercuric Hydroxid HG (OH) auszurüsten2, Quecksilberoxid (II) HGO ist etwas Lösliches in Wasser, das eine Lösung von Arten bildet, die als "Hydroxide" bezeichnet wird.
Diese Arten in Wasser, die als "Hydroxide" bezeichnet werden, sind schwache Basen und obwohl sie sich manchmal wie Amphotorate verhalten, im Allgemeinen das Hg (OH)2 Es ist grundlegender als Säure.
Wenn sich das HGO in HCLO auflöst4 Studien zeigen das Vorhandensein von Mercuric Ion Hg2+, Ein hgoh monohydroximercuro ion+ und Hg (OH) Mercuric Hydroxid2.
Die Ausgleiche, die in solchen wässrigen Lösungen auftreten, sind die folgenden:
Hg2+ + H2Oder ⇔ hgoh+ + H+
Hgoh+ + H2Oder ⇔ hg (OH)2 + H+
In NaOH -alkalischen Lösungen wird die Art HG (OH) gebildet3-.
Erhalten
Reines Quecksilberhydroxid
Quecksilberhydroxid (II) HG (OH)2 Es kann nicht in wässriger Lösung erhalten werden, da durch Zugabe von Alkali zu einer Lösung von HG -Händlerionen2+, das gelbe Quecksilberoxid ausfällt.
Einige Forscher konnten jedoch 2005 zum ersten Mal das HG (OH) Mercuric Hydroxid erhalten2 Unter Verwendung einer Quecksilber -ARC -Lampe aus dem Quecksilber -Hg -Element, Wasserstoff H2 und Sauerstoff oder2.
 Quecksilberlampe. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.Org/lizenzen/by-sa/2.0/at/Tat.In)]. Quelle: Wikipedia Commons.
Quecksilberlampe. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.Org/lizenzen/by-sa/2.0/at/Tat.In)]. Quelle: Wikipedia Commons. Die Reaktion ist photochemisch und wurde in Gegenwart von Neon, Argon oder festem Deuterium bei sehr niedrigen Temperaturen (ca. 5 K = 5 Grad Kelvin) durchgeführt. Die Nachweise der Verbindungsbildung wurden durch IR -Lichtabsorptionsspektren (Infrarot) erhalten.
Kann Ihnen dienen: NiederschlagDer Hg (OH)2 Auf diese Weise vorbereitet ist unter den Erfahrungbedingungen sehr stabil. Es wird geschätzt, dass die photochemische Reaktion durch den O-HG-O-Vermittler zum stabilen Molekül H-O-HG-O-H verläuft.
Coprecipitation mit Eisenhydroxid (III)
Wenn Quecksilbersulfat (II) HGSO löst4 und Eisensulfat (iii) Glaube2(SW4)3 Bei säurer wässriger Lösung, und der pH wird durch Zugabe einer NaOH -Natriumhydroxidlösung erhöht, ist nach einer Abschließung eines festgelegten Ruhestands ein koprezitierter Hg (OH)2 und Glaube (OH)3.
Es wurde festgestellt, dass die Bildung von Hg (OH)2 Es ist ein kritischer Schritt in dieser Coprecipitation mit Glauben (OH)3.
Die Bildung von Hg (OH)2 Im Niederschlag Glauben (OH)3-Hg (OH)2 Es hängt stark vom Vorhandensein von Ionen wie Fluorid, Chlorid oder Bromid ab, von der spezifischen Konzentration dieser und dem pH -Wert der Lösung.
In Gegenwart von Fluorid (f-), Ein pH -Wert von mehr als 5, die Coprezipitation von Hg (OH)2 Mit Glauben (OH)3 ist nicht betroffen. Aber zu einem pH von 4 die Bildung von Komplexen zwischen dem Hg2+ und f- stört die Coprecipitation von Hg (OH)2.
Im Falle der Anwesenheit von Chlorid (CL)-), Coprecipitation von Hg (OH)2 Es kommt zu einem pH von 7 oder mehr auf, dh vorzugsweise in alkalischem Medium.
Wenn das Bromid vorhanden ist (Br-), Coprecipitation von Hg (OH)2 Es erscheint bei noch größerem pH, dh pH über 8,5 oder mehr alkalisch als mit Chlorid.
Anwendungen
Aus der Überprüfung der verfügbaren Informationsquellen folgt, dass Mercury Hydroxid (ii) HG (OH) Mercury Hydroxid (ii)2, Als noch nicht kommerziell vorbereitete Verbindung hat sie keine Verwendungen bekannt.
Aktuelle Studien
Durch Berechnungssimulationstechniken im Jahr 2013 wurden die strukturellen und Energieeigenschaften mit der Hydratation von HG (OH) untersucht2 In einem gasförmigen Zustand.
Metall-Ligando-Koordination und Solvationsenergien wurden berechnet und durch Variation des Grades der Hg (OH) Hydratation verglichen2.
Unter anderem wurde festgestellt, dass anscheinend der theoretische Oxidationszustand 1+ anstelle der angeblichen 2+ ist, die normalerweise für Hg (OH) zugewiesen wurden, normalerweise zugewiesen2.
Kann Ihnen dienen: theoretische LeistungRisiken
Obwohl der Hg (OH)2 Als solcher wurde nicht in ausreichend quantisch isoliert.
Es kann für das Nervensystem, das Verdauungssystem, die Haut, die Augen, das Atmungssystem und die Nieren giftig sein.
Die Inhalation, Aufnahme oder Kontakt mit der Haut von Quecksilberverbindungen kann Schäden verursachen, die von der Reizung von Augen und Haut, Schlaflosigkeit, Kopfschmerzen, Zittern, Schäden am Darmtrakt, Gedächtnisverlust, der Niereninsuffizienz, zwischen anderen Symptomen reichen.
Quecksilber wurde international als Schadstoff anerkannt. Die meisten Quecksilberverbindungen, die mit der Umwelt in Kontakt kommen.
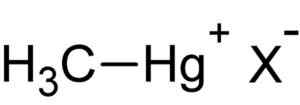 Methylquecksilber Hal. Autor: Hochgeladen von Benutzer: Schütze 82 82. Quelle: Unbekannt. Quelle: Wikipedia Commons.
Methylquecksilber Hal. Autor: Hochgeladen von Benutzer: Schütze 82 82. Quelle: Unbekannt. Quelle: Wikipedia Commons. Diese Verbindung ist Bioakkumula in lebenden Organismen, die vom Boden zu den Pflanzen und von dort zu den Tieren übergehen. In der aquatischen Umgebung ist der Transfer noch schneller und überschreitet in kurzer Zeit von sehr kleinen Arten zum großen.
Methylquecksilber hat eine toxische Wirkung für Lebewesen und insbesondere für das menschliche Wesen, das es durch die Nahrungskette aufnimmt.
Wenn mit Nahrung aufgenommen wird, ist für kleine Kinder und Feten bei schwangeren Frauen besonders schädlich.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Wang, Xuefeng und Andrews, Lester (2005). Infrarotspektrum von HG (OH)2 in soliden Neon und Argon. Anorganische Chemie, 2005, 44, 108-113. Aus Pubs geborgen.ACS.Org.
- Amaro-Östrada, j.Yo., et al. (2013). Wässrige Solvatation von Hg (OH)2: Energetische und dynamische Dichtefunktionstheoriestudien des HG (OH)2-(H2ENTWEDER)N (N = 1-24) Strukturen. J. Phys. Chem. Bis 2013, 117, 9069-9075. Aus Pubs geborgen.ACS.Org.
- Inoue, Yoshikazu und Munemori, Makoto. (1979). Coprecipitation von Quecksilber (ii) mit Eisen (iii) Hydroxid. Umweltwissenschaft und Technologie. Band 13, Nummer 4, April 1979. Aus Pubs geborgen.ACS.Org.
- Chang, l.W., et al. (2010). Nervensystem und Verhaltenstoxikologie. Im Verständnis der Toxikologie. Von Scientedirect erholt.com.
- Haney, Alan und Lipsey, Richard L. (1973). Akkumulation und Auswirkungen von Methylquecksilberhydroxid in einer terrestrarischen Nahrungskette unter Laborkondionen. Umfeld. Verschmutzung. (5) (1973) pp. 305-316. Von Scientedirect erholt.com.
- « Flavin Adenin Dinukleotid (FAD) -Merkmale, Biosynthese
- Glyceraldehyd 3-Phosphat (G3P) -Struktur, Funktionen »

