Nickelhydroxid (III) Struktur, Eigenschaften, Verwendungen, Risiken
- 3133
- 332
- Ivan Pressler
Er Nickelhydroxid (III) Es ist eine anorganische Verbindung, bei der das Nickelmetall eine Oxidationszahl von 3 hat+. Seine chemische Formel ist Ni (OH)3. Nach den konsultierten Quellen war es bisher nicht möglich, die Existenz von Nickelhydroxid (III) oder (OH) zu überprüfen3, Aber Nickel Oxo-Hydroxid (III), Kind (OH) wurde erhalten.
Nickel (III) NIO (OH) Oxohydroxid ist ein schwarzer kristalline Feststoff, der auf zwei Arten kristallisiert: die Beta -Form und Gamma. Die häufigste kristalline Form (OH) ist Beta.
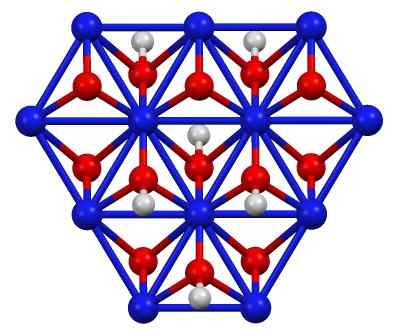
 Nickel Oxohydroxidstruktur (III), Kind (OH). Blau = nickel, rot = sauerstoff, weiß = Wasserstoff. Autor: Smokefoot. Quelle: eigene Arbeit. Quelle: Wikipedia Commons
Nickel Oxohydroxidstruktur (III), Kind (OH). Blau = nickel, rot = sauerstoff, weiß = Wasserstoff. Autor: Smokefoot. Quelle: eigene Arbeit. Quelle: Wikipedia Commons Das Kind (OH) kann durch Oxidation von Nickelnitratlösungen (ii) (oder (nein3)2) mit Chlor (CL)2) oder Brom (Brin)2) In Gegenwart von Kaliumhydroxid (KOH). Nickel (III) Oxohydroxid ist sehr löslich in Säuren. Es hat Anwendung in Nickelbatterien in Superca.
Nickel (III) NIO (OH) und Nickel Hydroxid (ii) oder (OH) (OH)2 Sie sind im Betrieb der meisten ihrer Anwendungen vereint, da beide Teil derselben Oxid-Reduktions-Gleichung sind.
Als Nickelverbindung stellt das Kind (OH) die gleichen Risiken anderer Nickelsalze dar, dh Hautreizung oder Dermatitis und Krebs.
[TOC]
Kristalline Struktur
Nickel Oxohydroxid (III) kristallisiert auf zwei Arten: Beta und Gamma. Die Beta-β-NIO-Form (OH) hat eine Struktur, die β-ni (OH) sehr ähnlich ist2, Was logisch erscheint, weil der erste aus der Oxidation des letzteren kommt.
Die γ-NIO (OH) -Gamma-Form ist das Oxidationsprodukt von Nickelhydroxid (II) in seiner Alpha, α-Ni (OH) -Form2. Wie letztere hat Gamma eine Schichtstruktur mit alkalischen Metallionen, Anionen und Wasser, die zwischen den Schichten durchsetzt sind.
Elektronische Konfiguration
Im Kind (OH) befindet sich der Nickel im Oxidationszustand 3+, was bedeutet, dass 3 Elektronen an den äußersten Schichten fehlen, dh zwei Elektronen der Schicht 4 fehlenS und ein Elektron aus Schicht 3D. Die elektronische Konfiguration von NI3+ Im Kind (OH) ist: [ar] 3D7, Wobei [AR] die elektronische Konfiguration von edlen Argongas ist.
Es kann Ihnen dienen: PI LinkNomenklatur
- Nio (OH): Nickel Oxohydroxid (III)
- Nickelschwarz
Eigenschaften
Körperlicher Status
Schwarzer kristalline Feststoff.
Löslichkeit
NIO (OH) Oxohydroxid ist sehr löslich in Säuren. Die Gamma -Phase löst sich in Schwefelsäure mit Sauerstoffentwicklung auf.
Andere Eigenschaften
In heißem Wasser wird es zu einem Oxohydroxid von Nickel (ii) und (iii) oder3ENTWEDER2(OH)4.
Es zersetzt sich auf 140 ° C in Nickel (II) (Kind und Sauerstoffoxid.
Die Gamma-Phase (γ-NIO (OH)) kann auf verschiedene Weise erhalten werden, beispielsweise die Behandlung von Nickel mit einer geschmolzenen Mischung aus Natriumperoxid (Na2ENTWEDER2) und Natriumhydroxid (NaOH) bei 600 ºC und Kühlung in Eiswasser.
Die Gamma -Phase bricht bei erhitztem auf 138 ºC zusammen.
Anwendungen
In Nickelbatterien
Edisons Nickel-Hydrum-Batterie, bei dem Koh als Elektrolyt verwendet wird, basiert auf der Nickel-Oxhydroxid-Reaktion (III) mit Eisen:
Herunterladen:
Fe + 2nio (OH) + H2Oder ⇔ Glaube (OH)2 + 2ni (oh)2
Last:
Es ist eine reversible Oxid-Reduktionsreaktion.
In der Anode dieser Batterien tritt eine Reihe von chemischen und elektrochemischen Prozessen auf. Unten ist ein allgemeines Schema:
Herunterladen
β-ni (OH)2 ⇔ β-nio (OH) + H+ + Und-
Last
Alterung ↑ ↓ Überlastung
Herunterladen
α-ni (OH)2 ⇔ γ-nio (OH) + H+ + Und-
Last
Kann Ihnen dienen: Arsen: Geschichte, Struktur, Eigenschaften, verwendetIn der Nickel -Batterie -Technologie wird Nickel Oxohydroxid (III) NIO (OH) "Nickel Active Mass" bezeichnet.
 Nickelaufladbare Batterien. Autor: superusgenerisch. Quelle: eigene Arbeit. Quelle: Wikipedia Commons.
Nickelaufladbare Batterien. Autor: superusgenerisch. Quelle: eigene Arbeit. Quelle: Wikipedia Commons. In der Elektrokatalyse als regenerierbarer Katalysator
Das Kind (OH) wurde erfolgreich in der Elektroynthese von Azopirazolen durch die elektrokatalitische Oxidation von Aminopyrazolen eingesetzt. Seine Nützlichkeit bei der Synthese von Carboxsäuren von Alkoholen oder Carbonylverbindungen wurde ebenfalls bewiesen.
 Erhalten einer Carbonsäure durch Oxidation eines vom Kind katalysierten Alkohols (OH). Quelle: Ursprünglich aus in.Wikipedia. Der ursprüngliche Autor -Uploader war V8RIK bei IN in.Wikipedia. Quelle: Wikipedia Commons
Erhalten einer Carbonsäure durch Oxidation eines vom Kind katalysierten Alkohols (OH). Quelle: Ursprünglich aus in.Wikipedia. Der ursprüngliche Autor -Uploader war V8RIK bei IN in.Wikipedia. Quelle: Wikipedia Commons Ein weiteres Beispiel ist das der quantitativen Umwandlung von Hydroxymethypyridin in eine Pyridokarbonsäure. In diesem Fall ist die Stahl- oder Nickelelektrode, die der Anode entspricht, mit einer Kinderschicht bedeckt (OH). Das Medium, in dem die Elektrolyse durchgeführt wird, ist alkalisch.
Bei diesen Reaktionen fungiert das Kind (OH) als Reduktionsmediator oder „Redox“ -Mediator.
Die Elektrolyse wird in einer Zelle mit Nickelanode und Titankathode in alkalischem Medium durchgeführt. Während des Prozesses wird es gebildet oder (OH)2 Auf der Oberfläche der Nickelanode, die schnell zum Kind (OH) oxidiert wird:
Ni (OH)2 + Oh- - Und- ⇔ nio (oh) + h2ENTWEDER
Das Kind (OH) reagiert mit dem organischen Substrat und das gewünschte organische Produkt wird erhalten, wodurch die NI (OH) regeneriert2:
NIO (OH) + organische Verbindung → Ni (OH)2 + Produkt
Wenn sich der Ni (OH) regeneriert2, Die Katalysereaktion wird fortgesetzt.
Die Verwendung des Kindes (OH) als Elektrokatisator ermöglicht es, organische Verbindungen mit geringen Kosten und auf umweltfreundliche Weise zu erhalten.
In Super Cardpisors
Das Kind (OH) zusammen mit dem Ni (OH)2 Sie bilden ausgezeichnete Materialien für Supercaiding -Elektroden (Englisch Superkapazitos).
Ni (OH)2 + Oh- ⇔ nio (oh) + h2Oder + e-
Sie haben eine hohe Kapazität, niedrige Kosten und nach einigen Referenzen unter Umweltauswirkungen.
 Kondensatoren in einer elektronischen Schaltung. Autor: pdphotos. Quelle: Pixabay.
Kondensatoren in einer elektronischen Schaltung. Autor: pdphotos. Quelle: Pixabay. Sie haben jedoch eine geringe Leitfähigkeit. Dies wird unter Verwendung von Nanopartikeln aus diesen Verbindungen gelöst, da somit die Oberfläche erhöht und die für die Diffusion erforderliche Entfernung verringert wird, was eine hohe Geschwindigkeit der Übertragung von Elektronen und/oder Ionen gewährleistet.
Kann Ihnen dienen: elastische MaterialienBei der Oxidation von Metallionen
Eine der kommerziellen Anwendungen von Nickeloxohydroxid (III) basiert auf seiner Fähigkeit, Kobaltionen (II) in Lösung für Kobaltionen zu oxidieren (III).
Risiken
In Lösung ist der Nickel als Ion stabiler oder2+, Daher ist es nicht üblich, mit NI in Kontakt zu kommen3+. Die Vorsichtsmaßnahmen sind jedoch gleich, da der Nickel, ob metallisch, in Lösung oder in Form seiner festen Salze, Hautsensibilisierung verursachen kann.
Es ist ratsam, Schutzausrüstung und Kleidung wie Gesichtsschild, Handschuhe und Sicherheitsschuhe zu verwenden. All dies muss jedes Mal verwendet werden, wenn es die Möglichkeit gibt, mit Nickellösungen in Kontakt zu kommen.
Wenn Dermatitis auftritt, sollte sie mit einem Arzt behandelt werden, um auszuschließen, dass sie durch Nickel verursacht wird.
Was die Möglichkeit des Einatmens betrifft, ist es eine gute Praxis.
Alle Nickelverbindungen werden von der International Cancer Research Agency (IARC (Akronym für Englisch "klassifiziert Internationale Agentur für Krebsforschung) in der Kategorie der Karzinogene für den Menschen.
Dies basiert auf epidemiologischen und experimentellen Daten.
Verweise
- Baumwolle, f. Albert und Wilkinson, Geoffrey. (1980). Fortgeschrittene anorganische Chemie. Vierte Edition. John Wiley & Söhne.
- Lyalin, geb.V. et al. Elektroynthese von Azopyrazolen durch Oxidation von N-Alkylaminopyrazolen auf einer Kinderanode in wässriger alkali-a-grünem Verfahren für N-N-Homokuple. Tetraeder Briefe. 59 (2018) 2741-2744. Von Scientedirect erholt.com.
- Liuyang, Zhang et al. (2018). Nickelbasierte Materialien für Superkapazitos. Materialien heute. Von Scientedirect erholt.com
- Ettel, v.ZU. und Mosolu, m. ZU. (1977). Vorbereitung von Nickelschwarz. ODER.S. Patent Nr. 4,006.216. 1. Februar 1977.
- Scharbert, geb. (1993). Prozess zum oxidierenden Hydroxymethylpyridin -Derivaten zu Pyridincarbonsäure -Derivaten an Nickeloxidhydroxid -Anoden. ODER.S. Patent Nr. 5,259,933. 9. November 1993.
- Kirk-Othmer (1994). Enzyklopädie der chemischen Technologie. Band 17. Vierte Edition. John Wiley & Söhne.
- Ullmanns Enzyklopädie der industriellen Chemie. (1990). FÜNFTE AUSGABE. Volumen bei 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Nickelhydroxides. Im Handbuch der Batteriematerialien. VCH Verlag. Von osti geborgen.Regierung.
- « Makrocomputergeschichte, Eigenschaften, Verwendungen, Beispiele
- Ausgewählte analoge Computer, Komponenten, Typen »

