Natriumhydroxid (NaOH) -Struktur, Eigenschaften, Verwendungen, Synthese

- 2566
- 600
- Frederike Birkemeyer
Er Natriumhydroxid Es ist eine anorganische Verbindung, deren chemische Formel NaOH ist und aus einer sehr starken Metallbasis oder Alkali besteht. Eine 5 %ige Lösung im Wasser hat einen pH -Wert von fast 14.
Es ist ein sehr hygroskopischer weißer Feststoff und kann auch Kohlendioxid der Luft aufnehmen, um Natriumcarbonat zu bilden. Kommerziell erhältlich in Plastikflaschen wie Pillen, die nicht zu viel Zeit in der Luft freigelegt werden können, und sie sollten auch nicht mit Spatel manipuliert werden.
 Natriumhydroxidpillen auf einem Uhrglas. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Walkerma nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain]
Natriumhydroxidpillen auf einem Uhrglas. Quelle: Kein maschinenlesbarer Autor zur Verfügung gestellt. Walkerma nahm an (basierend auf Urheberrechtsansprüchen). [Public Domain] Natriumhydroxid kann synthetisiert werden, wenn Calciumhydroxid mit Natriumcarbonat reagiert. Derzeit wird es grundlegend durch Soleelektrolyse synthetisiert und ist ein sekundäres Produkt der Gaschlorproduktion.
Geben. Es wird auch in Hausreinigung, Wasseraufbereitung, Aluminiumverarbeitung, medizinischer Herstellung usw. verwendet.; Und vor allem ist es ein sekundäres Muster par excellence.
Natriumhydroxid ist sehr ätzend und kann Reizungen, Hautverbrennungen und Augen erzeugen. Durch Einatmen seines Staubes kann es Lungenödem verursachen. Inzwischen kann seine Einnahme solche schweren Verletzungen des Verdauungstrakts verursachen, die zum Tod führen können.
[TOC]
Struktur
Wasserfrei
 Naoh -Ionen. Quelle: Gabriel Bolívar.
Naoh -Ionen. Quelle: Gabriel Bolívar. Das überlegene Bild zeigt die Ionen, aus denen NaOH besteht. Das na kation+ Es wird durch die lila Kugel dargestellt, während Hydroxylanion (Hydroxid oder Oxydril) OH- Für die rote und weiße Kugel. Beide NA -Ionen+ und oh- Sie interagieren miteinander durch die elektrostatische Anziehung ihrer entgegengesetzten Lasten.
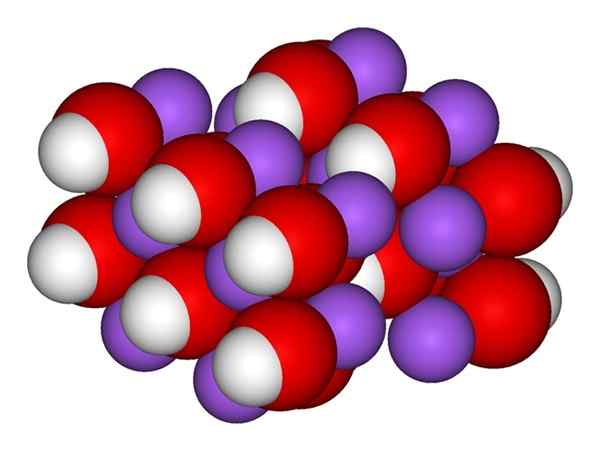 Natriumhydroxidstruktur
Natriumhydroxidstruktur Solche Wechselwirkungen sind nicht leitend, daher die Attraktionen eines ionischen NA+Oh- kann andere in einem bestimmten Abstand beeinflussen. Das Ergebnis ist, dass nationale Ionen+ Sie stoßen sich auf die gleiche Weise wie das OH ab-, bis zur Definition eines minimalen Energiekristalls, bei dem sie eine geordnete und regelmäßige Struktur (kristallin) festlegen,.
Daher erscheint die ortorrombischen Kristalle von NaOH -Anhydro (ohne Wasser):
 Darstellung der kristallinen Struktur von wasserfreiem Natriumhydroxid. Quelle: Quibik über Wikipedia.
Darstellung der kristallinen Struktur von wasserfreiem Natriumhydroxid. Quelle: Quibik über Wikipedia. Die Ionen bleiben kohäsiv genug für den wasserfreien NaOH -Kristall bis zur Base 323 ºC (vorausgesetzt, es gibt keine Feuchtigkeit in der Umwelt).
Hydrate
Sowohl die Na+ Wie oh- Sie sind Ionen, die Wassermoleküle locker (Hydrat) leicht. Dies begünstigt seine Hydratation über der retikulären Energie seiner Kristalle, so.
Es kann Ihnen dienen: Fehling Reaktion: Präparate, Wirkstoffe, Beispiele, VerwendungWasserdreidekristalle können jedoch Wassermoleküle ohne sich auflösen; Das heißt, Natriumhydroxid kann zahlreiche Hydrate bilden, NaOH · NH2ENTWEDER. Das Wassermolekül kann durchaus eine Wasserstoffbrücke mit OH bilden- (Hoh-oh-) oder mit der NA koordinieren+ (N / A+-Oh2).
Abhängig vom molaren Anteil zwischen NaOH und H2Oder Monohydrate können entstehen (Naoh · h2O), Dihydrate (NaOH · 2H2O), Trihemacrates (NaOH · 3.5H2O), Tetrahydrate (NaOH · 4H2O), Heptahridaten (Naoh · 7h2O) und andere.
Jedes diese Hydrate kann von einer wässrigen NaOH -Lösung mit unterschiedlichen Massenprozentsätzen und bei unterschiedlichen Temperaturen kristallisieren. Folglich weist NaOH ein kompliziertes Wasserlöslichkeitsdiagramm auf.
Im Allgemeinen sind Hydrate -Kristalle weniger dicht und haben niedrigere Schmelzpunkte. Dies liegt daran, dass die Wassermoleküle die Wechselwirkungen zwischen na "behindern"+ und oh-, Hinzufügen von Dipol-Dipolkräften beim Opfer ionischer Anziehungen.
Physikalische und chemische Eigenschaften
Namen
IUPAC bevorzugter Name: Natriumhydroxid. Andere Namen: ätzendes Soda, Ascarita (weniger häufig)
Molmasse
39.9971 g/mol
Aussehen
Feste oder weiße, seröse oder undurchsichtige Kristalle.
Schmelzpunkt
323 ºC
Siedepunkt
1.388 ºC
Wasserlöslichkeit
1.000 g/l bei einer Temperatur von 25 ºC. Dies zeigt, wie viel es sich in Wasser auflösen kann.
Seine wässrigen Lösungen sind viskoös, mit einem Viskositätswert fast achtzigmal höher als der von Wasser, und füllen am Anfang sehr Wärme frei. Wenn Sie Kontakt zu ihnen haben, drehen sie die rutschige Haut aufgrund der Saponifizierung der Fettsäuren der Haut.
Basizität (PKB)
- 0,56
pH
Eine 5 % P/P -Lösung im Wasser hat einen pH -Wert von fast 14
Brechungsindex (ND)
Bei einer Wellenlänge von 580,4 nm: 1.433 bis 320 ° C und 1.421 bis 420 ° C.
Stabilität
Die Behälter, die es enthalten, müssen dicht geschlossen sein, um Natriumcarbonatbildung zu verhindern. Dies ist auf seine hohe Hygroskopizität zurückzuführen, die dazu führt2.
Zersetzung
Wenn er zur Zersetzung erhitzt wird, emittiert ein Rauch aus Natriumoxid.
Selbststeuerung
Es ist nicht brennbar
Schmiere
4,0 CPOISE bei 350 ° C
Verdampfungswärme
175 kJ/mol a 1.388 ºC
Oberflächenspannung
74,35 Dynas/cm in einer 2,72 % P/P -Lösung in Wasser bei 18 ° C.
Reaktivität
Mit Säuren
Reagiert mit organischen und anorganischen Mineralsäuren, die Wasser und das entsprechende Salz verursachen. Bei Schwefelsäure ist die Reaktion exotherm.
Kann Ihnen dienen: Aluminiumsulfid (Al2s3): Struktur, Eigenschaften, verwendet2 NaOH+H2SW4 => Na2SW4 + 2 h2ENTWEDER
Mit Säureoxiden
Reagiert beispielsweise mit Schwefeldioxid, was ein Salz aus Sulfit und Wasser ergibt:
2 Naoh +so2 => Na2SW3 + H2ENTWEDER
Mit Metallen
Seine wässrigen Lösungen reagieren mit einigen Metallen, um komplexe Natriumsalze zu verursachen. Zum Beispiel führt seine Reaktion mit Zink zu einem Natriumzinkato:
Zn + 2 NaOH + 2 h2O => na2[Zn (OH)4] + H2
Synthese
Natriumhydroxid wird hauptsächlich mit zwei Methoden synthetisiert: die Verwendung von Natriumcarbonat, zunächst verwendet, und die Natriumchloridelektrolyse, derzeit mehr industrieller Verwendung.
Natriumcarbonatreaktion und Calciumhydroxid
Natriumcarbonat reagiert mit Calciumhydroxid in einem Prozess, der als Kaustifikation bezeichnet wird:
CA (OH)2 + N / A2CO3 => Caco3 + Naoh
Calciumcarbonat schlägt aus und lässt Natriumhydroxid im Überstand, das durch Verdunstung konzentriert wird.
Natriumcarbonat stammt zuvor aus dem Solvay -Prozess:
2 NaCl+ Caco3 => Na2CO3 + CaCl2
Natriumchloridelektrolyse
Die in Salzlake vorhandene Natriumchloridelektrolyse erzeugt Wasserstoffgas, Chloridgas und Natriumhydroxid in wässriger Lösung:
2 NaCl+2 h2O => h2 + Cl2 + 2 Naoh
Die elektrolytische Kammer besteht aus einem Kompartiment, in dem die Anode (+), des Titanmetalls und an Ort. Dieses Fach ist unter Verwendung einer porösen Membran vom Kathodenabteil (-) getrennt.
Die folgende Reaktion tritt an der Anode auf:
2 Cl- => Cl2 + 2 e- (Oxidation)
In der Zwischenzeit tritt diese Reaktion in der Kathode auf:
2 h2O +2 e- => H2 + Oh- (die Ermäßigung)
Das Natrium (na+) Diffusen Sie vom Anodenkompartiment zur Kathode durch die Membran, die sie trennt und Natriumhydroxid bildet.
Anwendungen
Reinigungsmittel
Natriumhydroxid wird zur Herstellung von Seifen und Reinigungsmitteln verwendet, die zu Hause und in der kommerziellen Aktivität verwendet werden. Die Kombination von Natrium- und Chlorhydroxid erzeugt Chlorbleiche, das in weißer Kleidung gewaschen wird.
Es eliminiert auch die Ansammlung von Fett in den Abflüssen und führt zu seiner Beseitigung durch seine Umwandlung in Seifen durch den Saponifikationsprozess. Dies ermöglicht die Beseitigung der Behinderung von Haushaltsrohren und anderen Gebäuden.
Pharmazeutische und medizinische Produkte
Natriumhydroxid wird zur Ausarbeitung gemeinsamer Analgetika wie Aspirin verwendet. Auch Medikamente mit Antikoagulanswirkung, die die Bildung von Blutgerinnseln und Medikamenten blockieren, um Hypercholesterinämie zu reduzieren.
Energieprozesse
Natriumhydroxid wird bei der Herstellung von Brennstoffzellen verwendet, die als Batterien zur Erzeugung von Strom für eine Vielzahl von Anwendungen, einschließlich Transport. Epoxidharze, die mit Natriumhydroxid -Intervention hergestellt werden, werden bei Windturbinen verwendet.
Es kann Ihnen dienen: galvanische Korrosion: Mechanismen, Beispiele, SchutzWasserversorgung
Natriumhydroxid wird verwendet, um die Wassersäure zu neutralisieren und zur Beseitigung von Schwermetallen davon beizutragen. Es wird auch für die Natriumhypochloritproduktion verwendet, ein Wasserdinfektionsmittel.
Natriumhydroxid reagiert mit Aluminiumsulfat zur Bildung von Aluminiumhydroxid: Flockungsmittel in Wasseraufbereitungsanlagen zur Erhöhung der Partikelsedimentation und erzeugt die Klärung.
Papierherstellung
Natriumhydroxid wird mit Natriumsulfid bei der Behandlung von Holz verwendet, um Cellulose auf eine fast reine Art und Weise zu erhalten. Es wird auch zum Recycling des Papiers verwendet.
Industrielle Fertigung
Natriumhydroxid wird zur Herstellung von Rayón, Spandex, Sprengstoff, Epoxidharzen, Glas und Keramik verwendet. Es wird in der Textilindustrie für Farbstoffe verwendet und Baumwollstoffe verarbeiten.
In Zuckerrohrbehandlungsanlagen wird Natriumhydroxid mit niedrigem Temperatur für die Zuckerrohrbagazo -Produktion verwendet.
Risiken
Natriumhydroxid ist eine hochkarrosiv.
In Kontakt mit den Augen kann es schwerwiegende Verbrennungen, Schwellungen, Schmerzen, verschwommenes Sehen erzeugen und in schweren Fällen dauerhafte Blindheit verursachen.
Die Einnahme von Natriumhydroxid kann Verbrennungen für Lippen, Zunge, Hals, Speiseröhre und Magen verursachen. Unter den üblichen Symptomen manifestieren sich Übelkeit, Erbrechen, Magenkrämpfe und Durchfall.
Obwohl die Inhalation des Natriumhydroxids selten ist und nur aufgrund des Vorhandenseins von herrschendem Staub in der Luft oder durch die Bildung eines TEW auftreten kann, der sie enthält, erzeugt es eine Reizung in der Lunge.
Bei einer chronischen Exposition kann dies zu Lungenödemen und schwerer Atemverkürzungen führen, was einen medizinischen Notfall darstellt.
Verweise
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid -Natrium. Abgerufen von: in.Wikipedia.Org
- Nationales Zentrum für Biotechnologie Information. (2019). Hydroxid -Natrium. Pubchem -Datenbank. CID = 14798. Erholt von: Pubchem.NCBI.NLM.NIH.Regierung
- Amerikanische Elemente. (2019). Natriumhydroxidlösung. Abgerufen von: Amerikanerungen.com
- Chemische Sicherheitsfakten. (2019). Hydroxid -Natrium. Erholt von: Chemicals -Sicherheitsfakten.Org
- NJ Gesundheit. (2015). Hydroxid -Natrium. [PDF]. Erholt von: NJ.Regierung
- Kanadisches Zentrum für Arbeitsgesundheit und Sicherheit. (2019). OSH beantwortet Faktenblätter: Natriumhydroxid. Geborgen von: cohs.AC
- Ausetute. (S.F.). Natriumhydroxid und Chlorproduktion durch Elektrolyse. Erholt von: Ausetute.com.Au
- « Chol -Sprache Ursprung, Eigenschaften, wo werden Sie gesprochen, Worte
- Indexierte Magazine Eigenschaften, Kriterien, einflussreiche Beispiele »

