Hydroxide
- 1709
- 486
- Frederike Birkemeyer
Was sind Hydroxide??
Der Hydroxide Sie sind anorganische und ternäre Verbindungen, die aus der Wechselwirkung zwischen einem Metallkation und der Funktionsgruppe OH bestehen (Hydroxidanion, OH-). Die meisten von ihnen sind ionischer Natur, obwohl sie auch kovalente Bindungen haben können.
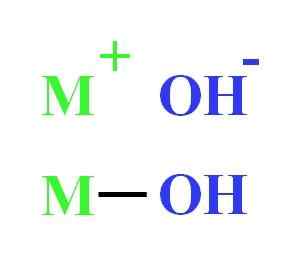
Beispielsweise kann ein Hydroxid als elektrostatische Wechselwirkung zwischen Kation M dargestellt werden+ und Anion oh-, oder als kovalente Vereinigung durch die M-OH-Verbindung (unteres Bild). Im ersten wird die ionische Bindung gegeben, während im zweiten der kovalent. Diese Tatsache hängt im Wesentlichen von Metall oder Cation ab+, sowie sein Last- und Ionenradio.
 Hydroxiddarstellung. Quelle: Gabriel Bolívar
Hydroxiddarstellung. Quelle: Gabriel Bolívar Da viele von ihnen aus Metallen stammen, ist es gleichermaßen, sie als Metallhydroxide zu erwähnen.
Wie werden Hydroxide gebildet??
Es gibt zwei wichtige synthetische Routen: durch Reaktion des entsprechenden Oxids mit dem Wasser oder mit einer starken Base in einem sauren Medium:
Mo + h2O => m (OH)2
Mo + h+ + Oh- => M (OH)2
Nur diese wasserlöslichen Metalloxide reagieren direkt zur Bildung von Hydroxid (erste chemische Gleichung). Andere sind unlöslich und erfordern saure Spezies, die M freisetzen+, die dann mit dem OH interagieren- aus starken Grundlagen (zweite chemische Gleichung).
Diese starken Basen sind jedoch Naoh, Koh und andere aus den alkalischen Metallen (Lioh, Rboh, CSOH) Metallhydroxiden (CSOH). Dies sind hochlösliche ionische Verbindungen im Wasser, daher ihre OH- Sie können an chemischen Reaktionen teilnehmen.
Andererseits gibt es unlösliche Metallhydroxide und sind folglich sehr schwache Basen. Sogar einige von ihnen sind sauer, wie es bei Tellursäure, TE (OH), der Fall ist6.
Hydroxid stellt ein Löslichkeitsbilanz mit dem Lösungsmittel um. Wenn es zum Beispiel Wasser ist, wird der Gleichgewicht wie folgt ausgedrückt:
M (OH)2 M2+(Ac) + oh-(Ac)
Wo (ac) bedeutet, dass das Medium wässrig ist. Wenn der Festkörper unlöslich ist, ist die aufgelöste Konzentration klein oder verabscheuungswürdig. Aus diesem Grund können unlösliche Metallhydroxide keine so grundlegenden Lösungen erzeugen wie NaOH.
Aus dem obigen kann es abgeben, dass Hydroxide sehr unterschiedliche Eigenschaften aufweisen, die mit der chemischen Struktur und den Wechselwirkungen zwischen Metall und OH verbunden sind. Obwohl viele ionisch sind und unterschiedliche kristalline Strukturen haben, haben andere stattdessen komplexe und unordentliche polymere Strukturen.
Hydroxideigenschaften
Oh Anion-
Hydroxylion ist ein Sauerstoffatom, das mit einem Wasserstoff verbunden ist. Dies kann also leicht als OH dargestellt werden-. Die negative Belastung befindet sich auf Sauerstoff und macht dieses Anion zu einem Speziesspender von Elektronen: eine Basis.
Wenn oh- Erledigte seine Elektronen zu einem Wasserstoff, ein H -Molekül gebildet2ENTWEDER. Sie können Ihre Elektronen auch für positive Lastarten spenden: als Metallzentren m+. Somit wird ein Koordinierungskomplex durch die M-OH-Dativverbindung gebildet (Sauerstoff liefert das Elektronenpaar).
Damit dies geschieht, muss Sauerstoff jedoch in der Lage sein, effizient mit Metall zu koordinieren, ansonsten haben Wechselwirkungen zwischen M und OH einen ausgeprägten ionischen Charakter (M+ Oh-).
Kann Ihnen dienen: volumetrische Pipette: Eigenschaften, Verwendung, Kalibrierung und FehlerDa das Hydroxylion in allen Hydroxiden gleich ist, liegt der Unterschied zwischen allen im Kation, das es begleitet.
Da dieses Kation aus dem Periodenverschluss (Gruppen 1, 2, 14, 15, 16 oder der Übergangsmetalle) aus jedem Metall stammen kann.
Ionischer und grundlegender Charakter
Hydroxide haben, obwohl sie Koordinationsverbindungen haben, einen latenten ionischen Charakter. In einigen, wie NaOH, sind seine Ionen Teil eines kristallinen Netzwerks, das von NA -Kationen besteht+ und oh Anionen- in den Proportionen 1: 1; das ist für jedes nationale Ion+ Es gibt ein Oh Ion- des Gegenstücks.
Abhängig von der Metalllast gibt es mehr oder weniger OH -Anionen- um es herum. Zum Beispiel für ein Metallkation m2+ Es wird zwei OH -Ionen geben- mit ihm interagieren: M (OH)2, Was sind Skizzen wie Ho- M2+ Oh-.
Genauso wie es mit Metallen auftritt m3+ und mit anderen positiveren Gebühren (obwohl sie 3+ selten überschreiten).
Dieser ionische Charakter ist für viele der physikalischen Eigenschaften wie Fusion- und Siedepunkte verantwortlich. Diese sind hoch, was die elektrostatischen Kräfte widerspiegelt, die innerhalb des kristallinen Netzwerks arbeiten. Wenn Hydroxide gelöst oder geschmolzen sind, können sie aufgrund der Mobilität ihrer Ionen einen elektrischen Strom leiten.
Allerdings haben nicht alle Hydroxide die gleichen kristallinen Netzwerke. Diejenigen mit den stabilsten werden weniger anfällig für sich in polaren Lösungsmitteln wie Wasser auflösen. In der Regel desto unterschiedlicher die ionischen Funkgeräte von m+ und oh-, Löslichere wird gleich sein.
Regelmäßiger Trend
Das obige erklärt, warum die Löslichkeit von alkalischen Metallhydroxiden im Abstieg der Gruppe zunimmt. Somit ist die wachsende Reihenfolge der Löslichkeiten in Wasser für diese wie folgt: looh OH- Es ist ein kleines Anion, und wenn das Kation sperriger wird, schwächt das kristalline Netzwerk die Energie. Andererseits bilden Alkalinotalmetalle aufgrund ihrer größten positiven Lasten weniger lösliche Hydroxide. Das liegt daran, dass m2+ Es zieht mehr Kraft in die OH an- im Vergleich zu m+. Ebenso sind seine Kationen kleiner und daher weniger ungleich in der Größe im Vergleich zu OH-. Das Ergebnis davon ist der experimentelle Beweis dafür, dass NaOH viel grundlegender ist als CA (OH)2. Die gleiche Argumentation kann auf andere Hydroxide angewendet werden, entweder für die von Übergangsmetallen oder für die des P -Blocks (Al, Pb, TE usw.). Auch je kleiner und groß der Ionenradius und die positive Belastung von m+, Minor wird der ionische Charakter von Hydroxid sein, mit anderen Worten, diejenigen mit sehr hohen Lastdichten. Ein Beispiel dafür tritt bei Beryl Hydroxid auf (OH)2. Er ist2+ Es ist ein sehr kleines Kation und seine trenale Belastung macht es elektrisch sehr dicht. M Hydroxides (OH)2 Reagieren Sie mit Säuren, um einen Aquokomplex zu bilden, dh m+ Enden, umgeben von Wassermolekülen. Es gibt jedoch eine begrenzte Anzahl von Hydroxiden, die auch mit den Basen reagieren können. Dies sind solche, die als Amphoteroshydroxide bekannt sind. Anfoterhydroxide reagieren sowohl mit Säuren als auch mit Basen. Die zweite Situation kann mit der folgenden chemischen Gleichung dargestellt werden: M (OH)2 + Oh- => M (OH)3- Aber wie man feststellt, ob ein Hydroxid Amphoter ist? Durch ein einfaches Laborexperiment. Da viele metallische Hydroxide in Wasser unlöslich sind, fügen Sie einer Lösung mit M -Ionen eine starke Basis hinzu+ zum Beispiel aufgelöst zu3+, Es wird das entsprechende Hydroxid ausfallen: Zum3+(AC) + 3OH-(ac) => ah (oh)3(S) Aber einen Überschuss an OH- Hydroxid reagiert weiterhin: Al (OH)3(s) + oh- => Al (OH)4-(Ac) Infolgedessen wird der neue negative Lastkomplex durch die umgebenden Wassermoleküle gelöst, wodurch der weiße Aluminiumhydroxid -Feststoff auflöst. Diese Hydroxide, die mit der zusätzlichen Basis -Addition unverändert bleiben. Hydroxide können kristalline Strukturen haben, die denen vieler Salze oder Oxide ähneln. einige einfache und andere sehr komplex. Darüber hinaus können diejenigen, bei denen ein ionischer Charakter abnimmt, Metallzentren aufweisen, die durch Sauerstoffbrücken (HOM-O-MOH) vereint sind. In Lösung sind die Strukturen unterschiedlich. Obwohl es für sehr lösliche Hydroxide ausreicht, sie als in Wasser aufgelöste Ionen zu betrachten, ist es für andere erforderlich, die Koordinierungschemie zu berücksichtigen. Somit, jedes Kation m+ Es kann mit einer begrenzten Anzahl von Arten koordiniert werden. Je sperriger, desto größer ist die Anzahl der Wasser- oder OH -Moleküle- mit ihm verbunden. Von hier aus entsteht die berühmte Koordination Octaederon vieler Metalle, die in Wasser (oder in einem anderen Lösungsmittel) gelöst sind: M (OH2)6+N, gleich der positiven Metallbelastung sein. Cr (OH)3, Zum Beispiel wirklich ein Oktaeder. Als? In Anbetracht der Verbindung als [Cr (OH) berücksichtigt2)3(OH)3], von denen drei der Wassermoleküle durch OH -Anionen ersetzt werden-. Wenn alle Moleküle durch OH ersetzt wurden-, Dann würde der negative Last und die oktaedrische Strukturkomplex [CR (OH) erhalten6]3-. Die Last -3 ist das Ergebnis der sechs negativen Ladungen der OH-. Hydroxide können als "hydratisierte Oxide" angesehen werden. In ihnen steht jedoch "Wasser" in direktem Kontakt mit M+; während in feuchtigkeitsspezifischen Oxiden Mo · NH2Oder Wassermoleküle sind Teil einer externen Koordinationskugel (sie sind nicht nahe am Metall). Diese Wassermoleküle können durch das Erhitzen einer Hydroxidprobe extrahiert werden: M (OH)2 + Q (Hitze) => Mo + H2ENTWEDER MO ist das metallische Oxid, das infolge einer Hydroxiddehydration gebildet wird. Ein Beispiel für diese Reaktion ist das, was beim Cupric -Hydroxid Cu (OH) dehydriert ist2: Cu (OH)2 (blau) + q => cuo (schwarz) + h2ENTWEDER Was ist der richtige Weg, um Hydroxide zu erwähnen? Die IUPAC erhöhte zu diesem Zweck drei Nomenklaturen: die traditionelle, die Aktie und die systematische. Für einige Hydroxide ist es jedoch richtig, eine der drei zu verwenden. Die traditionelle Nomenklatur besteht einfach darin, die höchste Valenz hinzuzufügen, die das Metall präsentiert. und das Suffix -nur das niedrigste. So hat beispielsweise Metall M Valences +3 und +1, Hydroxid M (OH)3 Es wird Hydroxid genannt (Metallname)ICO, während Moh Hydroxid (Metallname)tragen. Um festzustellen, was die Metallvalencia im Hydroxid ausreicht. So, M (OH)5 Es bedeutet, dass das Metall eine Last oder Valenz von +5 hat. Die Hauptnähe dieser Nomenklatur ist jedoch, dass sie für Metalle mit mehr als zwei Oxidationszuständen kompliziert werden kann (wie bei Chrome und Mangan). In solchen Fällen werden Hyper- und Hyperpräfixe verwendet, um die höchsten und niedrigsten Valenzen zu bezeichnen. Wenn M, anstatt nur Valences +3 und +1, zu haben, hat es auch +4 und +2, dann sind die Namen seiner größten Hydroxide und weniger Valences: Hydroxid Hyper(Metallname)ICO, und Hydroxid Schluckauf(Metallname)tragen. Von allen Nomenklaten ist dies die einfachste. Hier folgt der Name des Hydroxids einfach von der Valencia des in Klammern gesperrten Metall. Wieder für m (oh)5, Zum Beispiel wäre seine Aktiennomenklatur: Hydroxid (Metallname) (v). (V) Denota dann (+5). Schließlich wird die systematische Nomenklatur durch Rückgriff auf Multiplikator-Präfixe (di-, tri-, tetra-, penta-, hexa-, usw. zurückgegriffen.). Diese Präfixe werden verwendet, um sowohl die Anzahl der Metallatome als auch die OH -Ionen anzugeben-. Auf diese Weise die M (OH)5 Es heißt: Pentahidroxid von (Metallname). Im Fall von Hg2(OH)2, Zum Beispiel wäre es Dimercury Dihydroxid; Einer der Hydroxide, deren chemische Struktur auf den ersten Blick komplex ist. Einige Beispiele für Hydroxide und ihre entsprechenden Nomenklaturen sind die folgenden: -NaOH (Natriumhydroxid) -CA (OH) 2 (Calciumhydroxid) -Glaube (OH)3 (Eisenhydroxid; Eisenhydroxid (III); oder Eisen -Trihydroxid). -V (OH)5 (Pevanat Hydroxid; Vanadiumhydroxid (V); oder Vanadium Pentahidroxid). -Sn (oh)4 (Hydroxid isñico; Zinnhydroxid (iv) oder Tin Tetrahydroxid). -Ba (oh)2 (Bariumhydroxid oder Bariumdihydroxid). -Mn (OH)6 (Manganhydroxid, Manganhydroxid (VI) oder Mangan Hexahydroxid). -Augah (Argical Hydroxid, Silberhydroxid oder Silberhydroxid). Beachten Sie, dass für diese Verbindung keine Unterscheidung zwischen Aktien und systematischen Nomenklaturen besteht. -PB (OH)4 (Plúmbic Hydroxid, Bleihydroxid (IV) oder Tetrahydroxid). -Liop (Lithiumhydroxid). -CD (OH) 2 (Cadmiumhydroxid). -Ba (oh)2 (Bariumhydroxid). -Chromhydroxid.Anfoterismus
Strukturen
Dehydratisierungsreaktion
Hydroxid -Nomenklatur
Traditionell
Aktie
Systematisch
Beispiele für Hydroxide
 Natriumhydroxid -Aussehen
Natriumhydroxid -Aussehen  Erscheinen von Festkörpercalciumhydroxid
Erscheinen von Festkörpercalciumhydroxid Verweise

