Histidineigenschaften, Struktur, Funktionen, Lebensmittel
- 1696
- 300
- Nick Laurén
Der Histidin (His, H) Es ist eine Aminosäure, die für die Proteinsynthese verwendet wird. Es ist ein hydrophiles Molekül, daher ist es im Allgemeinen an der Außenseite von Proteinstrukturen ausgerichtet, wenn sie sich in einem flüssigen Medium befinden.
Es wird als essentielle Aminosäure für wachsende Kinder angesehen, da sie sie nicht produzieren. Bei Erwachsenen gibt es eine kleine Histidinproduktion, aber es reicht nicht aus, die täglichen Anforderungen zu liefern, sodass es als halbwesentliche Aminosäure angesehen wird.
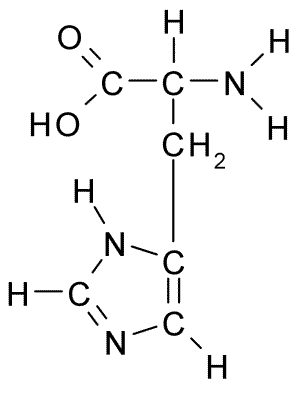
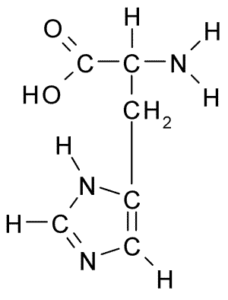 Chemische Struktur der Histidinaminosäure (Quelle: Borb über Wikimedia Commons)
Chemische Struktur der Histidinaminosäure (Quelle: Borb über Wikimedia Commons) Für Tiere und der Mensch ist Histidin eine wesentliche oder zumindest halbwichtige Aminosäure. Pflanzen, Pilze und Mikroorganismen produzieren jedoch effizient das Histidin, das sie benötigen.
Histidin erfüllt sehr wichtige physiologische Funktionen beim Menschen wie folgt: diejenigen, Teil der aktiven Zentren vieler Enzyme zu sein, die am Wachstum, im Immunsystem und in der Bildung von Myelin in Nervenfasern beteiligt sind.
Die Histidin -Biosynthese ist ein komplexer Prozess, der hauptsächlich in der Leber stattfindet und 9 bis 11 enzymatische Schritte erfordert. Sein Abbau tritt in Leber und Haut auf und durchläuft die Bildung von Glutamat und folgt dann verschiedenen Wegen.
Viele Lebensmittel sind reich an Histidin wie tierischen Proteinen wie Fleisch und Milchprodukten sowie Pflanzenproteine. Diese bieten einen Großteil der täglichen Anforderungen an Histidin, die unser Körper ordnungsgemäß funktionieren muss.
Das Defizit oder das überschüssige Histidin, das durch Erben von Stoffwechsel- oder Transportproblemen oder Nahrungsversagen bei der Aufnahme verursacht wird, hängen mit einigen wichtigen Problemen zusammen, die die Gesundheit sowohl bei Kindern als auch bei Erwachsenen beeinflussen. Durch ausreichender Histidinkonsum können Sie in den meisten Fällen ein gesundes und gesundes Leben aufrechterhalten.
[TOC]
Eigenschaften
Ein hervorgehobenes Merkmal von Histidin ist, dass es in Histamin umgewandelt werden kann, eine Substanz, die aktiv an vielen allergischen und entzündlichen Reaktionen teilnimmt.
In den Fischen, die ohne ausreichende Kühlung der Umwelt ausgesetzt sind, können Bakterien Histidin in Histamin umwandeln, und deshalb verursachen sie bei der Einnahme eine Lebensmittelvergiftung.
Ein weiteres Merkmal dieser Aminosäure ist, dass sie einer der wenigen unter den bestehenden 22 ist, die im Bereich des physiologischen pH -Werts (um 7).4) Es ist ionisiert und kann daher aktiv an der katalytischen Stelle vieler Enzyme teilnehmen.
Im Hämoglobinmolekül ist proximales Histidin eines der Hämogruppenliganden. Mit anderen Worten, diese Aminosäure beteiligt sich an der Sauerstofftransportfunktion von Hämoglobin und ist für die Synthese dieses Proteins sowie für Myoglobin, das auch als „Muskelhämoglobin“ bezeichnet wird, unverzichtbar.
Struktur
Histidin ist eine Aminosäure Hydrophil Polar- essentiell, In essentiellen Aminosäuren klassifiziert, da sie nicht von Tieren synthetisiert werden kann. Wie bereits erwähnt, wird es jedoch von Bakterien, Pilzen und Pflanzen synthetisiert.
Bei wachsenden Kindern ist Histidin absolut notwendig. Der Erwachsene kann es synthetisieren, aber es ist nicht klar, ob dies die täglichen Bedürfnisse von Histidin bedeckt. Daher muss er mit der Ernährung aufgenommen werden.
Wie alle Aminosäuren hat Histidin einen α -Kohlenstoff, zu dem eine Aminogruppe, eine Carboxylgruppe, ein Wasserstoffatom und eine Seitenkette verbunden ist.
Kann Ihnen dienen: coxiella burnetiiDie laterale Kette dieser Aminosäure wird durch einen Imidazolring gebildet, der zu physiologischem pH -Wert Protonen und positive Belastung erlangt und genannt wird. "Imidazolio " abgekürzt wie IMH+.
Zusammen mit Lysin und Arginin bildet Histidin die Gruppe grundlegender Aminosäuren. Von den drei ist Histidin am wenigsten grundlegend und sein Imididoólica -Ring kann ungeschützt sein, um den pH -Wert nahe 6 zu schützen.
Da physiologisches pH -Histidin Protonen austauschen kann, beteiligt sich dies normalerweise an der enzymatischen Katalyse, die den Transfer von Protonen beinhaltet. Da es sich um eine polare Aminosäure handelt, befindet es sich normalerweise auf der Außenfläche der Proteine, wo es in einem wässrigen Medium hydratisieren kann.
Funktionen
Als Teil der aktiven Enzymstelle
Histidin ist für die Synthese vieler Proteine erforderlich, insbesondere Enzyme, deren aktive Zentren diese Aminosäure haben. Es ist Teil des aktiven Zentrums der Säugetier -Aldlasasen, wo es als Protonenspender fungiert.
Es befindet sich im aktiven Zentrum von Carboxipeptidase A, einem Pankreasenzym mit einem aktiven Standort, das von Zn und Histidin gebildet wird. Im Glykolithischen Enzym mutasa phosphoglycerate gibt es in seinem aktiven Zentrum zwei Histidinabfälle, die als Akzeptoren oder Spender von Phosphorylgruppen fungieren.
Es wird auch in der aktiven Stelle von Enzymen wie Glyceraldehyd 3-phosphat-Dehydrogenase, Lactatdehydrogenase, Papain, Chimotripsin, RNASA A und Ammoniak-LIASA-Histidin (Histidase) gefunden. Darüber hinaus ist es ein Inhibitor der Enzym Glutamin -Synthetase.
Andere Funktionen
Diese Aminosäure ist für den Organismus von großer Bedeutung, da die Decarboxylase Histidin Decarn.
Histidin wird von Neuronen des Zentralnervensystems mit neuromodulatorischen Funktionen erzeugt.
Es ist für die Bildung von Myelin -Schoten von Nervenfasern notwendig, daher spielt es eine wichtige Rolle bei der Übertragung elektrischer Impulse in ihnen.
Zusammen mit Wachstumshormon und anderen Aminosäuren trägt Histidin zu Gewebereparaturmechanismen bei, hauptsächlich im kardiovaskulären System.
Einige zusätzliche Funktionen umfassen:
- Trägt mit der Entgiftung einiger Schwermetalle bei, da es sich wie Chelating verhält.
- Schützt vor Schäden durch Strahlung.
- Nehmen Sie an der Bildung von roten und weißen Blutkörperchen teil.
- Es ist für die Bildung von Hämoglobin erforderlich.
- Es hilft bei einigen negativen Auswirkungen von rheumatoider Arthritis wie Entzündungen und mangelnder Mobilität.
- Es ist eine wichtige Aminosäure für Kapillarregeneration, Wachstum und sexuelle Funktion.
Carnosin, Anserin und Homokosin sind Dipéptide aus Histidin. Die ersten beiden sind in den Muskeln zu finden und haben wichtige Funktionen wie Tamponer und als Aktivatoren von Myosin Atasa.
Homokosin wird im Gehirn in Höhe von 100 -mal höher als im Skelettmuskel fleischig erzeugt.
Biosynthese
Histidin erhält sein kohlensüchtiges Skelett aus der 5-phosphat-Ribose. In den Bakterien UND. Coli, Diese Aminosäure tritt aus der Verbindung mit 11 enzymatischen Schritten aus:
- Der erste Schritt der Synthese besteht in der Übertragung eines Phosphotribosyls von ATP zu Kohlenstoff 1 der 5-phosphat-Ribose, wodurch 5-phosphorribosyl-1-pyrophosphat (PRPP) (PRPP) erzeugt wird. Die Phosphotribosyl-Pyrophosphat-Synthetase (PRPP-Synthetase) -Enzym katalysiert diese Reaktion.
- Dann tritt die Übertragung der Kohlenstoffpyrophosphatgruppe 1 auf das n-1 des ATP auf, und das N1- tritt auf (5'-phosphorribosyl) -ATP. Das Enzym, das diese Reaktion katalysiert.
- Durch die Wirkung von Phosphorribosyl-Top-Pyrophosphathydroxylase α, β-Pyophosphat-Verbindung des ATP ist Hydroxilase und das N1-AMP (5'-Phosphorribosyl) -AMP gebildet.
- Die Phosphotribosyl-Map-Enzymhydroxylase öffnet den Purinring zwischen N-1 und C-6.
- Dann wird der Ribofuranosa-Ring, der aus dem PRPP stammt.
- Das Aminotransferase-Enzym überträgt die Amid-Gruppe von Glutamin, die zu Glutamat wird, und bricht die Formimin-Verbindung aus, so.
- Ein Wassermolekül des Imidazol-Glycerolphosphat wird mittels des Imidazol-Glycerol-Phosphat-Dehydratase eliminiert und bildet Imidazol-Acetol-Phosphat.
- Das Imidazol-Acetol-Phosphat wird eine Aminogruppe durch Histidinol-Transaminase-Phosphat übertragen und das Phosphat-Histidinol wird gebildet.
- Die phosphorische Estergruppe von Histidinolphosphat zur Bildung von Histidinol ist hydrolysiert. Histidinol -Phosphat -Fospatase katalysiert diese Reaktion.
- Später wird Histidinol durch Histidinol -Dehydrogenase oxidiert und ist histidinal.
- Das gleiche Histidinol -Dehydrogenase oxidiert zum Histidinal und macht es Histidin.
Das erste Enzym des Biosynthesewegs von Histidin wird durch das Produkt des Weges gehemmt, dh das Histidin beteiligt.
Degradierung
Histidin, Prolin, Glutamat, Arginin und Glutamin sind Aminosäuren, die bei der Bildung von α-Zotoglurat. Vier von ihnen werden zuerst Glutamat, was aufgrund einer Transaminierung zu α-Ketoglutorat führt.
Histidin verliert durch Histidinase die α-Amino-Gruppe, um Urocanato zu werden. Dann feuchtigkeits der Urocanase die Positionen 1 und 4 der Urocanato und bildet das 4-Midazolon-5-Propionat. Anschließend tritt die Imino-Gruppe des 4-Midazolon-5-Propionato auf und bildet das N-Formiminoglutamato.
Die letzte Reaktion impliziert die Übertragung des Formyls vom N-Formiminoglutamat auf Tetrahydropholat, das mit dem Enzym Glutamat formiminöser Transfer arbeitet. Die endgültigen Produkte dieser Reaktion sind Glutamat und N5-Formimino-Tetrahydropholat.
Α-Ketoglutarat wird durch Glutamattransaminierung gebildet. Α-Ketoglutarat ist ein Vermittler des Krebszyklus und kann auch in den gluconeogenen Weg für die Glukosebildung eintreten.
Die Glutamato -Amino -Gruppe tritt in den Harnstoffproduktionszyklus ein, der durch den Urin beseitigt werden soll. Alle diese Reaktionen treten in der Leber und in einem Teil von ihnen auf der Haut auf.
Lebensmittel, die reich an Histidin sind
Der tägliche Histidinbedarf beträgt ungefähr 10 bis 11 mg pro kg Körpergewicht und Tag. Bei wachsenden Kindern ist Histidin eine essentielle Aminosäure, die mit der Ernährung geliefert werden muss.
Bei anderen Tieren ist Histidin auch eine essentielle Aminosäure, und solche, die in Ställen angehoben werden.
Unter den Lebensmitteln, die reich an Histidin sind, sind:
- Rindfleisch, Lamm, Schweinefleisch, Hühnchen und Truthahn. Es kommt auch in Fischen wie Thunfisch (sogar in Dosen), Lachs, Forellen, Pargo und Lubina sowie in einigen Meeresfrüchten vor.
Kann Ihnen dienen: Blutkultur: Wofür ist es, Fundament, Verfahren, Ergebnisse- Milch und seine Derivate, insbesondere in reifen Käsesorten wie Parmesan, Gruyere, Schweizer Käse, Gouda unter anderem. In den Eingeborenen, im Serum, im Joghurt und in der sauren Sahne.
- Sojabohnen und Nüsse wie Nüsse und Samen. In Sonnenblume, Kürbis, Wassermelone, Sesam, Mandeln, Pistazien, Erdnussbutter und Chia.
- Eier und Bohnen oder weiße Bohnen.
- Vollkornprodukte wie Quinoa, Weizen, integraler Reis usw.
Vorteile Ihrer Aufnahme
Es gibt eine Reihe pathologischer Erkrankungen, unter denen Histidin als Adjuvans für die Behandlung nützlich sein kann.
Unter diesen Pathologien können wir rheumatoide Arthritis, arterielle Hypertonie (da eine blutdrucksenkende Wirkung von Histidin beschrieben wurde), bei Infektionen, Frigidität und Geschlecht und Hören, Geschwüren und Anämien nennen).
In der Haut erzeugt der Verbrauch von Histidin Urocansäure, der die Haut schützen kann, da sie ultraviolette Strahlen absorbiert.
Übermäßiger Verbrauch durch gesunde Personen führt nicht zu erheblichen Veränderungen, da er schnell verschlechtert wird. Die Verwendung von Histidin -Nahrungsergänzungsmitteln bei Patienten mit schwerer Leber- und/oder Nierenprobleme sollte jedoch eingeschränkt werden.
Mangelerkrankungen
Das Histidin -Defizit hängt mit Veränderungen der immunverträgigen Immunantwort zusammen.
Es wurden auch Knochenprobleme, Taubheit und Anämien im Zusammenhang mit Histidindefizit berichtet.
Die Hartnup -Krankheit ist eine erbliche Erkrankung, die den Transport von Histidin und Tryptophan durch die Schleimhaut des dünnen Darms und der Nieren beeinflusst, was ein Defizit beider Aminosäuren verursacht.
Die relevantesten klinischen Manifestationen sind das Erscheinen schägiger und roter Läsionen in der Haut nach Sonneneinstrahlung, verschiedenen Bewegungsgraden und einigen Symptomen von psychiatrischen Erkrankungen.
Histidinämie ist eine autosomische rezessiv.
Infolgedessen können diese Patienten Histidin in Leber und Haut nicht auf Urocal -Säure abbauen. Diese Krankheit wird von mäßiger geistiger Behinderung, Sprachfehlern und Hörgedächtnis ohne Taubheit begleitet.
Die Einschränkung der Histidinaufnahme als Behandlung war bei der Erzeugung klinischer Verbesserungen nicht wirksam und besteht das Risiko, bei Kindern, die von dieser Krankheit betroffen sind, Wachstumsstörungen zu erzeugen.
Verweise
- Mathews, c., Van Holde, K., & Ahern, k. (2000). Biochemie (3. Aufl.). San Francisco, Kalifornien: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Harpers illustrierte Biochemie (28. ed.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger Prinzipien der Biochemie. Omega -Ausgaben (5. Aufl.). doi.Org
- Perecarz, p., Farri, l., & Papageorgiou, a. (1983). Die Auswirkungen von Helsmilch- und niedrig-Protein-Formeln auf die Raten der Gesamtkörperproteinverschiebung und der 3-Methylhistidin-Ausscheidung von Frühgeborenen von Frühgeborenen. Klinische Wissenschaft, 64, 611-616.
- Lied, b. C., Joo, n., Aldini, g., & Yeum, k. (2014). Biologische Funktion von Histidin-Dipeptiden und metabolischem Syndrom. Ernährungsforschung und -praxis, 8(1), 3-10.
- « Sauerstoffeigenschaften, Struktur, Risiken, verwendet
- Expertensystemgeschichte, Merkmale, Vorteile, Nachteile »

