Holoenzymeigenschaften, Funktionen und Beispiele
- 2473
- 150
- Said Ganzmann
A Holoenzym Es handelt. Weder der Unterstützer noch der Cofaktor sind aktiv, wenn sie getrennt sind; Das heißt, um zu funktionieren, müssen sie gekoppelt werden.
Somit sind Holoenzyme kombinierte Enzyme und folglich katalysator aktiv. Enzyme sind eine Art von Biomolekülen, deren Funktion im Grunde die Geschwindigkeit von Zellreaktionen erhöht. Einige Enzyme brauchen die Hilfe anderer Moleküle, die als Cofaktoren bezeichnet werden.
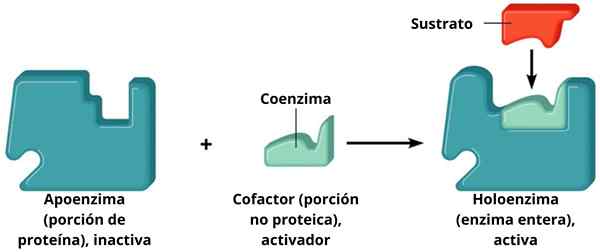
 Unterstützung + Cofaktor = Holoenzym
Unterstützung + Cofaktor = Holoenzym Die Cofaktoren ergänzen sich mit den Stützen und bilden ein aktives Holoenzym, das die Katalyse durchführt. Diejenigen Enzyme, die einen bestimmten Cofaktor benötigen, werden als konjugierte Enzyme bezeichnet. Diese haben zwei Hauptkomponenten: den Cofaktor, der ein metallisches (anorganisches) Ion oder ein organisches Molekül sein kann; Das Apoenzym, Proteinteil.
[TOC]
Eigenschaften von Holoenzymen
Von Anhängern und Cofaktoren gebildet
Unterstützung sind der Proteinteil des Komplexes, und Cofaktoren können organische Ionen oder Moleküle sein.
Zeigen Sie eine Vielzahl von Cofaktoren ein
Es gibt verschiedene Arten von Cofaktoren, die helfen, Holoenzyme zu bilden. Einige Beispiele sind Coenzyme und häufige Vitamine, zum Beispiel: Vitamin B, FAD, NAD+, Vitamin C T Coenzym A.
Einige Cofaktoren mit Metallionen, zum Beispiel: Kupfer, Eisen, Zink, Kalzium und Magnesium unter anderem. Eine andere Art von Cofaktoren sind die sogenannten prothetischen Gruppen.
Temporal oder ständige Gewerkschaft
Cofaktoren können die Unterstützung mit unterschiedlicher Intensität vereinen. In einigen Fällen ist die Union schwach und vorübergehend, während die Union in anderen Fällen so stark ist, dass sie dauerhaft ist.
In Fällen, in denen die Gewerkschaft nur vorübergehend ist, wird es wieder unterstützt, wenn der Cofaktor aus dem Holoenzym eliminiert wird, und hört auf, aktiv zu sein.
Funktion
Holoenzym ist ein Enzym, der bereit ist, seine katalytische Funktion auszuüben. das heißt, bestimmte chemische Reaktionen zu beschleunigen, die in verschiedenen Bereichen erzeugt werden.
Funktionen können je nach spezifischer Wirkung von Holoenzym variieren. Zu den wichtigsten gehören die DNA -Polymerase, deren Funktion es ist, sicherzustellen, dass die Kopie der DNA korrekt erfolgt.
Kann Ihnen dienen: Ardipithecus: Entdeckung, Eigenschaften, SchädelBeispiele für gemeinsame Holoenzyme
RNA -Polymerase
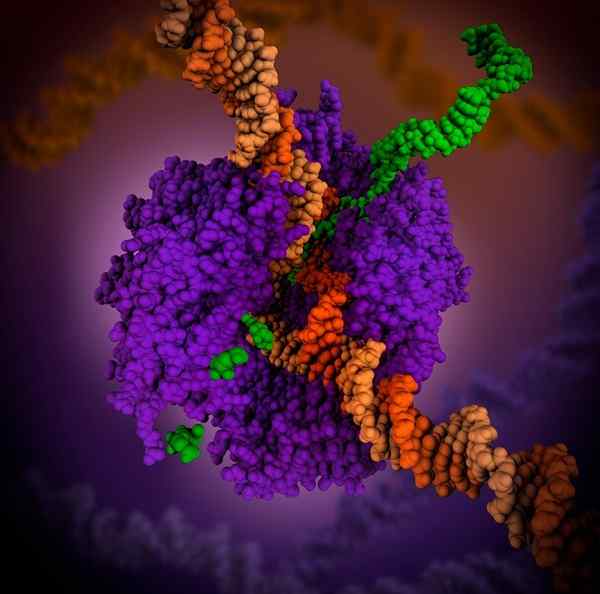 3D -Polymerase -RNA. Quelle: Maria Voigt., CC um 4.0, über Wikimedia Commons
3D -Polymerase -RNA. Quelle: Maria Voigt., CC um 4.0, über Wikimedia Commons RNA -Polymerase ist ein Holoenzym, das die Reaktion der RNA -Synthese katalysiert. Dieses Holoenzym ist notwendig, um RNA -Ketten aus DNA -Formketten zu bauen, die während des Transkriptionsprozesses als Vorlagen fungieren.
Seine Funktion besteht darin, Ribonukleotide am Ende 3 eines wachsenden RNA -Moleküls hinzuzufügen. In Prokaryoten benötigt die RNA -Polymeraseunterstützung einen Cofaktor namens Sigma 70.
DNA -Polymerase
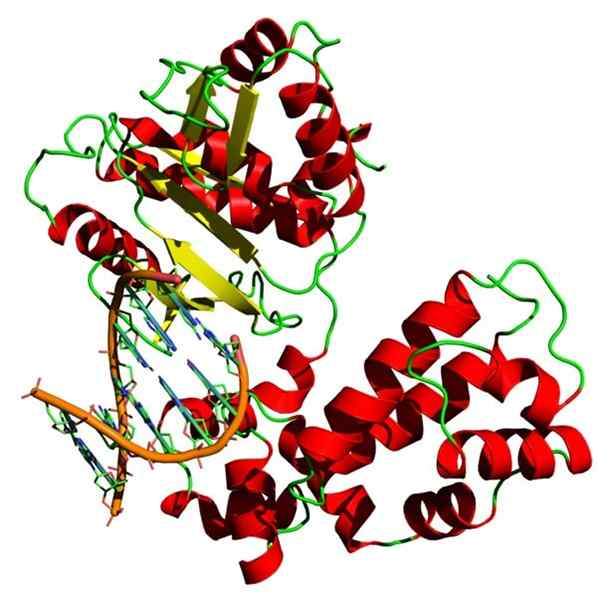 Homiens Homo Sapiens Beta Beta -DNA -Struktur. Quelle: Yikrazuul, CC BY-SA 3.0, über Wikimedia Commons
Homiens Homo Sapiens Beta Beta -DNA -Struktur. Quelle: Yikrazuul, CC BY-SA 3.0, über Wikimedia Commons DNA -Polymerase ist auch ein Holoenzym, das die DNA -Polymerisationsreaktion katalysiert. Dieses Enzym erfüllt eine sehr wichtige Funktion für Zellen, da es für die Replikation genetischer Informationen verantwortlich ist.
Die DNA -Polymerase benötigt ein Ion mit positiver Ladung, normalerweise Magnesium, um seine Funktion auszuführen.
Es gibt verschiedene Arten von DNA -Polymerase: DNA -Polymerase III ist ein Holoenzym mit zwei zentralen Enzymen (Pol III), jede Verbindung von drei Untereinheiten (α, ɛ und θ), eine Gleitklemme mit zwei Beta -Untereinheiten und einem Lastkomplex Einstellung mit mehreren Untereinheiten (δ, τ, γ, ψ und χ).
Carboanhydrase
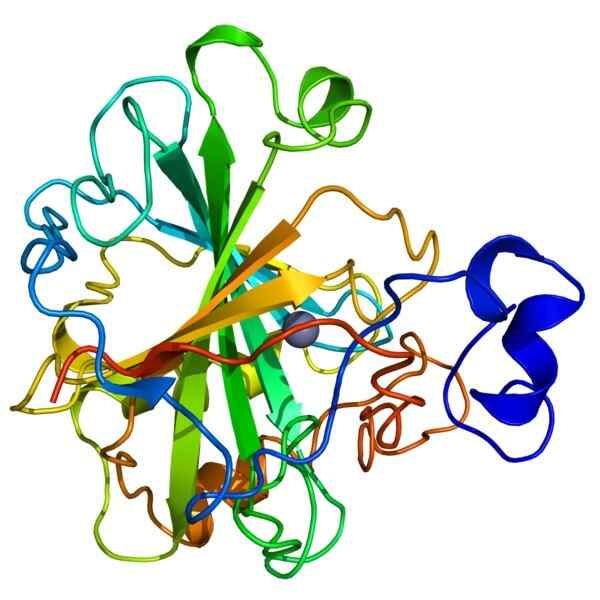 Kohlensäureanhydrasestruktur
Kohlensäureanhydrasestruktur Carbonische Anhydrase, auch Carbonat -Dehydration genannt, gehört zu einer Familie von Holoenzymen, die die schnelle Umwandlung von Kohlendioxid (CO₂) und Wasser (H20) in Bicarbonat (H2CO3) und Protonen (H+) katalysieren.
Das Enzym benötigt ein Zinkion (Zn+2) als Cofaktor, um seine Funktion auszuführen. Die durch carbonische Anhydrase katalysierte Reaktion ist reversibel, aus diesem Grund wird ihre Aktivität als wichtig angesehen, da sie das Säure-Basis-Gleichgewicht zwischen Blut und Geweben aufrechterhält.
Hämoglobin
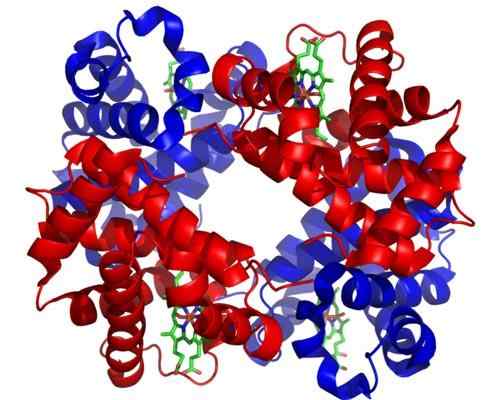 Hämoglobin
Hämoglobin Hämoglobin ist ein sehr wichtiges Holoenzym für den Transport von Gas in tierischen Geweben. Dieses in rote Blutkörperchen vorhandene Protein enthält Eisen (Fe+2), und seine Funktion besteht darin, Sauerstoff aus der Lunge in andere Körperbereiche zu transportieren.
Kann Ihnen dienen: photosynthetische OrganismenDie molekulare Struktur von Hämoglobin ist ein Tetramer, was bedeutet, dass sie aus 4 Polypeptidketten oder Untereinheiten besteht.
Jede Untereinheit dieses Holoenzyms enthält eine Hämogruppe, und jede Hämogruppe enthält ein Eisenatom, das Sauerstoffmoleküle beitreten kann. Die Hämoglobin -Hämogruppe ist ihre prothetische Gruppe, die für ihre katalytische Funktion erforderlich ist.
Cytochromoxidase
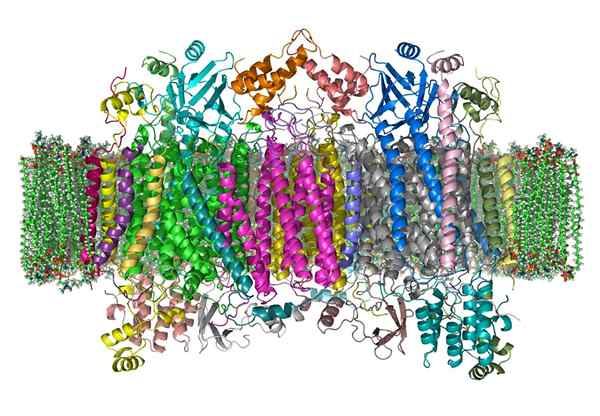 Cytochromoxidase
Cytochromoxidase Das Oxidase -Cytochrom ist ein Enzym.
Es ist ein komplexes Holoenzym.
Pyruvatkinase
 Cytochromoxidase
Cytochromoxidase Das Kinase -Pyruvat ist ein weiteres wichtiges Holoenzym für alle Zellen, da es an einer der universellen Stoffwechselstrecken beteiligt ist: Glykolyse.
Seine Funktion besteht darin, die Übertragung einer Phosphatgruppe eines Moleküls namens Phosphoenolpyruvat auf ein anderes Molekül namens Diphosphat -Adenosin zu katalysieren, um ATP und Pyruvat zu bilden.
Die Unterstützung erfordert Kaliumkationen (K ') und Magnesium (Mg+2) als Cofaktoren, um funktionelles Holoenzym zu bilden.
Carboxylase -Pyruvat
 Carboxylase -Pyruvat
Carboxylase -Pyruvat Ein weiteres wichtiges Beispiel ist das Carboxylase Pyruvat, ein Holoenzy. Somit wird Pyruvat zu Oxalacetat, ein wichtiger Vermittler im Stoffwechsel.
Um funktionell aktiv zu sein, benötigt das Foose -Carboxylase -Pyravate einen Cofaktor namens Biotin.
Acetyl -CoA -Carboxylase
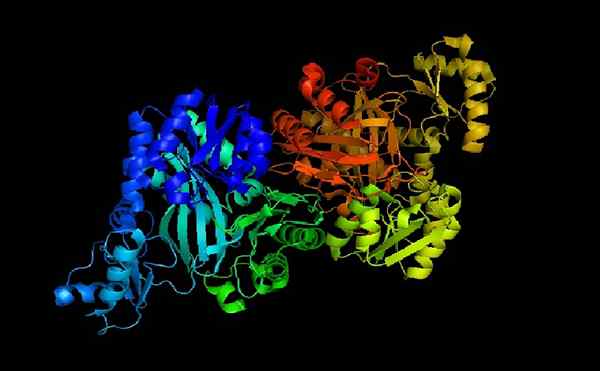 Acetyl CoA Carboxylase E-Coli
Acetyl CoA Carboxylase E-Coli Acetyl-CoA-Carboxilase ist ein Holoenzym, dessen Cofaktor, wie er unter seinem Namen angegeben ist, das Coenzym ist.
Wenn Apoenzym und Coenzym A gekoppelt sind, ist Holoenzym katalytisch aktiv, um ihre Funktion auszuführen: Übertragen Sie eine Carboxylgruppe auf Acetyl-CoA, um es in Malonyl Coenzym A (Malonyl-CoA) zu verwandeln, um es in Malonyl Coenzym zu verwandeln (Malonyl-CoA).
Kann Ihnen dienen: Locken: Komposition, Teile, WichtigkeitAcetyl-CoA erfüllt wichtige Funktionen sowohl in tierischen als auch in pflanzlichen Zellen.
Oxidase -Monoamin
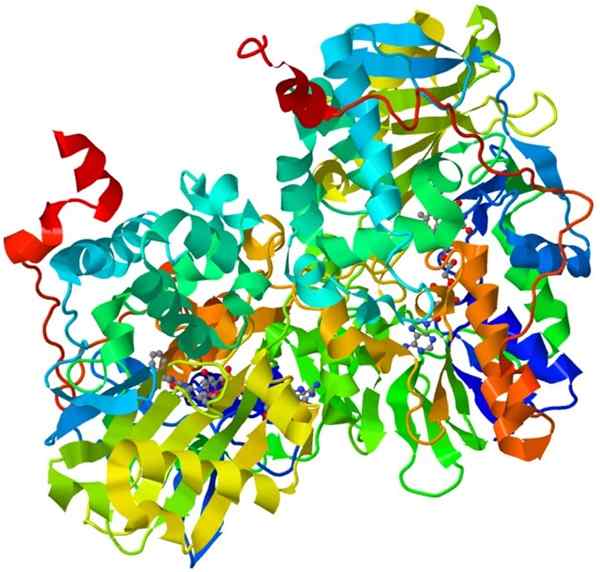 Oxidase -Monoaminstruktur
Oxidase -Monoaminstruktur Dies ist ein wichtiger Holoenzym im menschlichen Nervensystem. Seine Funktion besteht darin, den Abbau bestimmter Neurotransmitter zu fördern.
Damit Oxidase -Monoamin katalytisch aktiv sein kann, muss es seinen Cofaktor, den Flavin und den Adenin -Dinukleotid (Modeerscheinung) kovalent vereinen.
Laktat -Dehydrogenase
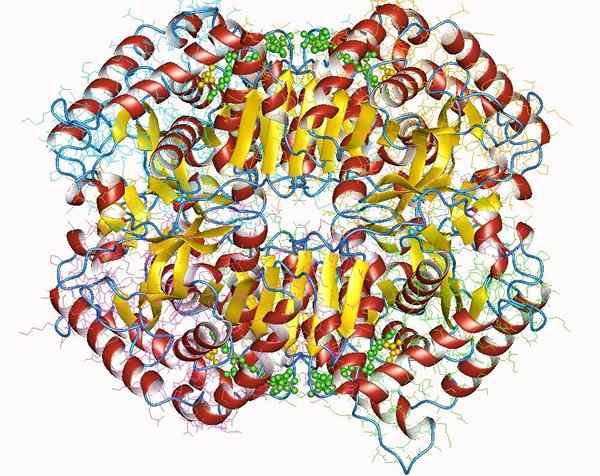 Laktat -Dehydrogenase
Laktat -Dehydrogenase Lactatdehydrogenase ist ein wichtiges Holoenzym für alle Lebewesen, insbesondere in Geweben, die viel Energie verbrauchen, wie Herz, Gehirn, Leber, Skelettmuskel, Lungen, unter anderem.
Dieses Enzym erfordert das Vorhandensein seines Cofaktors, Nikotinamid und Adenin (NAD), um die Umwandlungsreaktion von Laktatpyruvat zu katalysieren.
Katalase
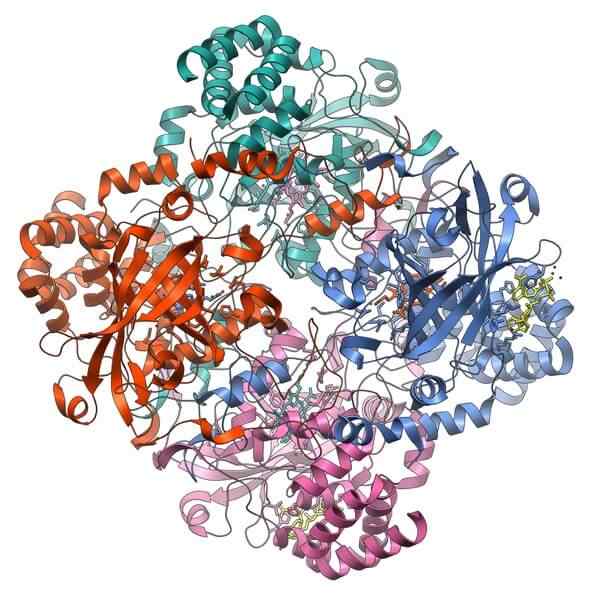 Katalaseproteinstruktur. Quelle: Vossman, CC BY-SA 3.0, über Wikimedia Commons
Katalaseproteinstruktur. Quelle: Vossman, CC BY-SA 3.0, über Wikimedia Commons Katalase ist ein wichtiges Holoenzym zur Vorbeugung der Zelltoxizität. Seine Funktion besteht darin, Wasserstoffperoxid zu zersetzen, Produkt des Zellstoffwechsels, Sauerstoffs und Wasser.
Die Unterstützung von Catalase erfordert zwei Cofaktoren, um zu aktivieren: ein Manganion und eine Hämoprothesegruppe, ähnlich wie Hämoglobin.
Verweise
- Lathappilly, f. K., & Hendrickson, W. ZU. (1995). Struktur der Biotinyldomäne von Acetyl-Coenzym A Carboxylase, die durch Mad-Phasing bestimmt wird. Struktur, 3(12), 1407-1419.
- Berg, j., Tymoczko, j., Gatto, g. & Streyer, l. (2015). Biochemie (8. Aufl.). W. H. Freeman und Gesellschaft.
- Fegler, j. (1944). Funktion von carbonischer Anhydrase im Blut. Natur, 137-38.
- Gaweska, h., & Fitzpatrick, p. F. (2011). Strukturen und Mechanismus der Monoaminoxidasefamilie. Biomolekulare Konzepte, 2(5), 365-377.
- Gupta, v., & Bamezai, r. N. K. (2010). Humanpyruvatkinase M2: ein multifunktionales Protein. Wissenschaftsprotein, 19(11), 2031-2044.
- Jitrapakdee, s., St. Maurice, m., Rayment, ich., Cleland, w. W., Wallace, J. C., & Attwood, p. V. (2008). Struktur, Mechanismus und Regulation von Pyruvat -Carboxylase. Journal Biochemical, 413(3), 369-387.
- Muirhead, h. (1990). Isoenzyme der Pyruvatkinase. Transaktionen der biochemischen Gesellschaft, 18, 193-196.

