Wachstumshormon (Somatotropin) Struktur, Funktionen
- 2717
- 578
- Said Ganzmann
Der Somatotropin (STH) U -Wachstumshormon (GH) ist ein relativ kleines Protein, das auf der Ebene der Adenohypophyse produziert wird und an Entwicklungsprozessen, dem Längswachstum des Organismus und der Kontrolle mehrerer Stoffwechselprozesse beteiligt ist.
Es ist ein Nicht -Glaro -Hormon. Die Glandotropashormone der Hypophyse versammeln sich.
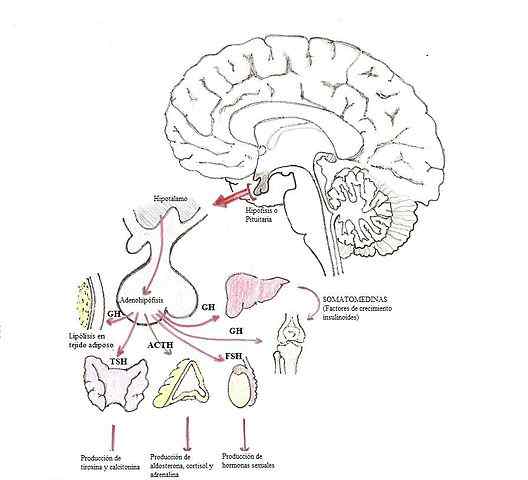
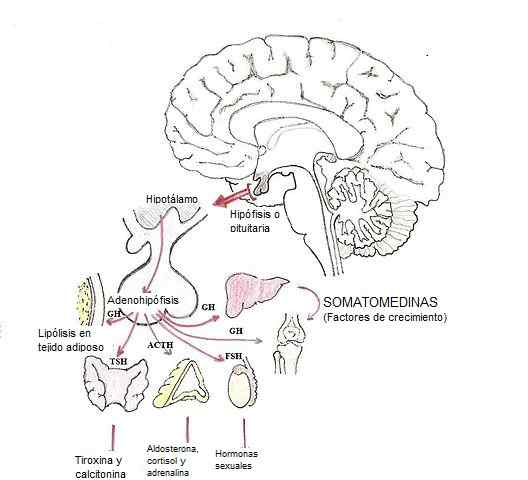 Modifikation von Hormonen in der Hypophyse (Quelle: Dubaele / Public Domain über Wikimedia Commons)
Modifikation von Hormonen in der Hypophyse (Quelle: Dubaele / Public Domain über Wikimedia Commons) Glandotropas -Hormone sind beispielsweise Adrenocortopin (ACTH), Gonadotropine (FSH und LH) und Schilddrüsenstimulierung Hormon (TSH).
Nicht -Glandropas -Hormone hingegen und darunter Prolaktin und Wachstumshormon enthalten ohne den Wettbewerb einer anderen endokrinen Drüse, da sie ihre Handlungen direkt auf die weißen Zellen ausüben, deren Aktivitäten regulieren.
[TOC]
Struktur
Wachstumshormon ist ein relativ kleines Protein, das in mehreren Isoformen auftritt. Die Hauptisoform besteht aus etwa 191 Aminosäuren, hat ein 22 kDa-Molekulargewicht und stammt aus einem länger.
In seiner Struktur scheint Somatotropin auf Prolaktin und chorionische Somatomamototropin (CS) homologisch zu sein, letztere in der Plazenta. Dies ist die Ähnlichkeit, die betrachtet wird, dass die drei eine hormonelle Familie bilden.
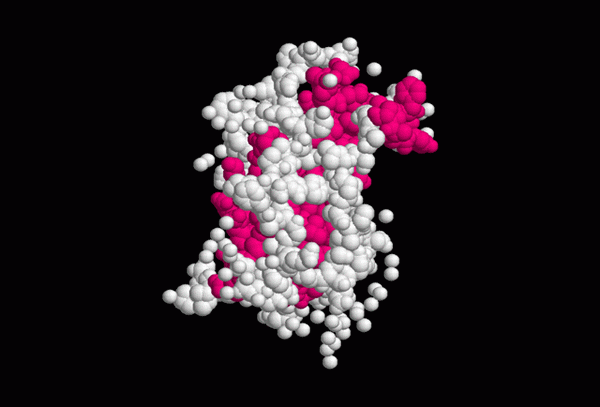 Ungefähre Struktur des Wachstumshormons (Quelle: рützen über Wikimedia Commons)
Ungefähre Struktur des Wachstumshormons (Quelle: рützen über Wikimedia Commons) Die sekundäre Struktur von Somatotropin zeigt 4 Alpha -Propeller, die mit zwei Disulfidbrücken stabilisiert wurden, deren Konfiguration für die Wechselwirkung des Hormons mit seinem Empfänger erforderlich ist.
Eine Tatsache in Bezug auf die Struktur und es verdient es, hervorgehoben zu werden, stellt die Tatsache dar, dass trotz der Tatsache, dass die Wachstumshormone verschiedener Arten bemerkenswerte Ähnlichkeiten mit dem Menschen haben, nur Letztere und die von Primaten ausüben.
Funktionen
Somatotropinfunktionen werden normalerweise als solche beschrieben, die mit der Entwicklung und dem Wachstum des Organismus verbunden sind. Auch diejenigen, die mit Metabolismus assoziiert sind, darunter Modifikationen des Lipidstoffwechsels und Glukose, die durch Hormon gefördert werden.
Wachstumsfunktionen können jedoch auch als metabolisch angesehen werden, da sie anabolische Funktionen implizieren, die mit der Proteinsynthese assoziiert sind, was einige andere Funktionen ohne direkten Assoziation mit dem Stoffwechsel wie der Zellproliferation nicht ausschließt.
Einige der Funktionen oder Aktionen, die von Somatotropin eingesetzt werden.
IGF -Synthese
Die erste Linie der Somatotropinwirkung ist genau die Synthese dieser Substanzen, die als Wachstumsfaktoren ähnlich wie Insulin (IGF) bekannt sind, von denen die Typen 1 und 2 identifiziert wurden. Sie sind gemäß ihrem Akronym in Englisch als IGF1 (das Wichtigste) und IGF2 ausgewiesen.
Diese Faktoren waren ursprünglich bekannt und sind immer noch als Mediatoren von Somatotropin oder Somatomedinen C (IGF1) und A (IGF2) oder auch als eine Aktivität, die dem nicht -suppressiblen Insulin (NSILA) ähnelt, bezeichnet. Sie werden von vielen Zelltypen synthetisiert, treten jedoch hauptsächlich in der Leber auf.
Die Handlungen des STH und des IGF1 sind sehr unterschiedlich. Einige üben jede dieser Substanzen unabhängig aus, manchmal in Verbindung und synergistisch und andere Male wirken sie antagonisch.
Kann Ihnen dienen: Elektrophorese: Fundament, Technik, Wo was es heißt, BeispieleWachstumsinduktion
Dies ist eines der wichtigsten Aktionen, die von Somatotropin gefördert werden, aber in Verbindung mit dem IGF1 ausgeführt wird. Obwohl beide das Wachstum zahlreicher Körpergewebe induzieren, wird ihr wichtigstes Effekt auf das Skelettwachstum ausgeübt.
Dieses Endergebnis wird durch mehrere durch das Hormon und das IGF1 induzierte Effekte erzeugt. Dazu gehören die Zunahme der Proteinablagerung durch chondrozytische und osteogene Zellen, die höchste Reproduktionsrate dieser Zellen und die Umwandlung von Chondrozyten in osteogene Zellen; All dies führt zur neuen Knochenablagerung.
Während des Wachstums und der Entwicklung des Organismus und vor dem Verschluss der Knochen -Epiphysen wird neuer Knorpel in Epiphysen abgelagert, gefolgt von der Umwandlung in einen neuen Knochen, der die Diaphyse verlängert und die Epiphysen getrennt sind.
Der progressive Verbrauch von epiphysealem Knorpel erschöpft es und der Knochen kann nicht weiter wachsen. Am Ende der Jugend werden die Diaphyse und Epiphysen und das Wachstum der langen Knochenlänge auf jedes Ende verlangsamt und schließlich stoppt.
Ein zweiter Mechanismus kann die Zunahme der Knochendicke erklären. Die Osteoblasten des Periostiums legen den alten neuen Knochen ab, und die Osteoklasten eliminieren den alten Knochen. Wenn die Ablagerungsrate die Eliminierung überschreitet, steigt die Dicke an.
Da das Wachstumshormon eine intensive Stimulation auf Osteoblasten ausübt, kann die Dicke der Knochen weiter zunehmen.
Förderung der Proteinablagerung in Geweben
Dieser Effekt kann durch verschiedene Mechanismen erreicht werden: die Zunahme des Transports von Aminosäuren durch Zellmembranen, die Zunahme der RNA Katabolismus.
Andere Stoffwechselaktionen
In Fettgewebe fördert Wachstumshormon die Lipolyse und Freisetzung von Fettsäuren in den Kreislauf Torrent, was seine Konzentration in Körperflüssigkeiten erhöht. Gleichzeitig bevorzugt es in allen Geweben die Umwandlung von Fettsäuren in Acetyl -Coenzym A und ihre Verwendung als Energiequelle.
Die Stimulation der Verwendung von Fetten zusammen mit der Akkumulation von Proteinen aufgrund ihres anabolen Effekts führt zu einer Zunahme des mageren Gewebes.
Die Zunahme der Mobilisierung von Fetten kann so hoch sein, dass die Leber große Mengen Acetoessigsäure erzeugt, die zu Ketose führen, und eine Fettleber kann erzeugt werden.
In Bezug auf den Metabolismus von Kohlenhydraten umfasst die Auswirkungen von Somatotropin die Abnahme der Glukosesammlung in Fett- und Muskelmuskulargewebe, eine erhöhte Glukoseleberproduktion und eine erhöhte Insulinsekretion.
Alle diese Effekte werden als Diabetogene bezeichnet, und Hochwachstumshormonsekretion kann metabolische Veränderungen reproduzieren, die nicht -insulin -abhängige Typ -II -Diabetes begleiten.
Andere Funktionen
Die anabolen und mitogenen Wirkungen des GH und des IGF1 manifestieren sich auch in der Wachstum und Funktion des Herzens, der Leber, der Milz, der Schilddrüse, des Thymus und der Zunge. Das Hormon kann zur Verdickung der Haut, zur Stimulation der Schweißdrüsen und des Haarwachstums beitragen.
In den Nieren die glomeruläre Filtrationsrate und die Synthese von Calcitriol erhöht sich, was nicht nur Wachstum, sondern auch Knochenmineralisierung begünstigt. Es fördert auch die Erythropoese- und Fibrinogensynthese und die Immunantwort durch Stimulierung von T -Lymphozyten und Makrophagen.
Kann Ihnen dienen: Epithelgewebe: Eigenschaften, Beschreibung, Funktionen, TypenRezeptoren für Somatotropin
Somatotropinaktionen, einschließlich der Förderung der Synthese von Wachstumsfaktoren, die Insulin ähneln, werden durch ihre Vereinigung mit spezifischen Rezeptoren vermittelt, die in weißen Zellmembranen exprimiert werden.
Es gibt zwei Formen dieser Rezeptoren, von denen die zweite eine kurze (verkürzte) Variante der ersten ist; Verkürzte Form, die die Funktion des langen Empfängers hemmt und dass sie, wenn sie übersexprimiert ist.
Der lange Empfänger besteht aus 638 Aminosäuren und verfügt. Jedes Somatotropin -Molekül verbindet zwei Empfängermoleküle und produziert sogenannte Rezeptordimerisierung.
Diese Dimerisierung aktiviert ein JAK2 -Kinase -Protein, das sich an den intrazellulären Enden jedes Monomers des Empfängers und diese aktiven Kinase -Phosphorylat anderer Substrate wie STAT5 und dem Somatotropin -Rezeptor selbst phosphorylieren,.
Die phosphorylierten STAT5 -Moleküle erleiden ebenfalls eine Dimerisierung.
Produktion
Somatotropin wird auf der Ebene der Adenohypophyse -Somatotropas -Zellen synthetisiert. Diese Zellen sind intensiv mit sauren Substanzen gefärbt, so dass sie auch Acidophile genannt werden. Sie sind zusammen die am häufigsten vorkommende Zellgruppe der Drüse, da sie 50% der insgesamt 5 verschiedenen Typen ausmachen.
Es gibt einen genetischen Komplex von 5 Genen im langen Arm des menschlichen Chromosoms 17, der für die verschiedenen Isoformen des Wachstumshormons und für das menschliche Chorion -Somatomamototropin (HCS) kodiert, die kodiert, die für die verschiedenen Isoformen des Wachstums kodiert, die.
Einer von ihnen ist der normale HGH-N, der für die am häufigsten vorkommende Form des menschlichen Wachstumshormons kodiert, das von 22 kDa erwähnt ist und 75% des gesamten zirkulierenden Wachstumshormons ausmacht.
Seine Messenger -RNA ist ausgesetzt "Schneiden und Spleißen" eine kleinere Form des Hormons von 20 kDa zu produzieren, der Aminosäureabfälle von 32 bis 46 fehlt und 10% entspricht.
Ein zweites Gen (HGH-V) wird hauptsächlich in der Plazenta exprimiert und codiert eine Variantenform von HGH, von der nur signifikante Mengen im Kreislauf während der Schwangerschaft auftreten. Die anderen 3 Gene codieren Isoformen des Somatomamototropin -Menschen.
Freigeben
Sowohl die Synthese als auch die Sekretion oder Freisetzung von Wachstumshormon werden durch stimulierende und inhibitorische Faktoren solcher Funktionen reguliert.
Anregende Einflüsse
Unter den wichtigsten humorvollen Einflüssen stimulierende Synthese und Somatotropinsekretion sind GHRH -Peptide (Wachstumshormon -Freisetzung Hormon) und Ghrelin.
Das Wachstumshormon befreiende Hormon (GHRH) ist ein hypothalamisches Peptid, das in zwei Varianten von 40 bzw. 44 Aminosäuren vorhanden ist. Es leitet in Somatotropaszellen zur Synthese von AMPC und zur Aktivierung des spezifischen PIT1 -Transkriptionsfaktors für das Wachstumshormon.
Ghrelin ist ein Wachstumshormon des Wachstumshormons. Es ist ein Peptid von etwa 28 Aminosäuren, die auf Hypothalamus und Magenebene synthetisiert wurden. Es handelt synergistisch mit GHRH, dessen Freisetzung fördert, während Somatostatin hemmt. Wirkt durch Rezeptoren, die Phospholipase C aktivieren.
Einige metabolische Parameter wie Hypoglykämie, niedrige Spiegel an freien Fettsäuren im Blut und hohe Aminosäurekonzentrationen sind wichtige Stimuli für die Sekretion des Wachstumshormons.
Kann Ihnen dienen: Die 12 Stufen der menschlichen Entwicklung und deren MerkmaleAndere stimulierende Faktoren, die zählen.
Hemmende Einflüsse
Darunter sind Somatostatin oder Hormoninhibitor der Wachstumshormonfreisetzung (GHRIH) und negatives Feedback.
Somatostatin ist ein hypothalamisches Peptid von 14 Aminosäuren, die die Sekretion, aber nicht die Synthese des Wachstumshormons, hemmen. Eine lange Variante, 28 Aminosäuren, wird im Magen -Darm -Trakt synthetisiert. Beide Varianten binden an denselben Empfänger und hemmen die cyclische AMP -Synthese.
Was das negative Feedback betriff. Der IGF1 hemmt den Hypothalamus an das Wachstumshormon des Wachstumshormons und stimuliert Somatostatin, während die GH -Synthese in der Hypophyse hemmt.
Einige metabolische Parameter wie Hyperglykämie, hohe Plasmaspiegel an freien Fettsäuren und niedrigen Aminosäurespiegeln sind Somatotropin -Sekretionsinhibitoren.
Inhibitoren sind auch kalt, chronischer Stress, Adipositas, Progesteron, Schilddrüsenhormone, Defizite oder Cortisol -Exzesse und Stimulation der adrenergen Rezeptoren β2 β2.
Dosis
Der therapeutische Einsatz von biosynthetisiertem Wachstumshormon ist für die Behandlung der Leiden angezeigt, bei denen ein Mangel an seiner Sekretion, bei Hypophysen -Zwergwidrismus und bei niedrigem Bereich Kinder durch das Turner -Syndrom, offenbart wurde.
Die Verabreichung wird in Form einer injizierbaren Lösung vorgenommen, die von einer Straße umgebaut wird, die ein mit 40 u lyophilisiertem Lösung enthält.Yo. des Biosynthesehormons und zu denen die 2 ml Gefährten von 0,9 % Natriumchloridlösung zugesetzt werden.
Im Wachstumshormonmangel bei Kindern wird zwischen 0,07 und 0,1 u empfohlen.Yo./kg Körpergewicht pro Tag. Im Turner -Syndrom 0,14 u.Yo./kg Körpergewicht pro Tag. Für Wachstumshormonmangel bei Erwachsenen: 0,018 bis 0,036 u.Yo./kg Körpergewicht pro Tag.
Auswirkungen
Die therapeutische Verabreichung von Wachstumshormon kann von einigen unerwünschten Kollateraleffekten wie der offensichtlichen Überempfindlichkeit durch verallgemeinerte Urtikaria, Fastenhypoglykämie, Entzündung am Injektionsort und Kopfschmerzen im Fahrgastunternehmen begleitet werden.
Die Entwicklung einer bestimmten gutartigen intrakraniellen Hypertonie wurde beschrieben, bei Kindern häufiger und bei Erwachsenen weniger.
In Bezug auf den Kohlenhydratstoffwechsel wurde bei Patienten, die mit Wachstumshormon behandelt wurden, über die Entwicklung von Diabetes mellitus berichtet.
In Bezug auf das Skelettmuskelsystem gibt es Hinweise darauf.
Es wurden Fälle von Gynäkomastie, Anämie und akuter Pankreatitis berichtet.
Verweise
- Ganong WF: Die Hypophyse, 25. Aufl. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Hypophysenhormone und ihre Kontrolle durch den Hypothalamus, in Lehrbuch der medizinischen Physiologie, 13. ED, AC Guyton, Je Hall (Hrsg.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormon, in Physiologie des Menschen -Milben Pathophysiologie, 31. ED, RF Schmidt et al. (Hrsg.). Heidelberg, Springer Medizin Verlag, 2010
- Voigt K: Endokrines -System, in Physiologie, 6. Ausgabe; R Klinke et al. (Hrsg.). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H und Strang KT: Das endokrine System. Die Hypothalamus und Hypophyse in Vanders menschlicher Physiologie: Die Mechanismen der Körperfunktion, 13. Aufl.; EP Windmaier et al. (Hrsg.). New York, McGraw-Hill, 2014.

