indisch

- 2358
- 335
- Tizian Liebich
 Metallisches indisches Stück. Quelle: Hi-Res-Bilder von chemischen Elementen [CC by (https: // creativeCommons.Org/lizenzen/bis/3.0)]]
Metallisches indisches Stück. Quelle: Hi-Res-Bilder von chemischen Elementen [CC by (https: // creativeCommons.Org/lizenzen/bis/3.0)]] Was ist der Inder?
Er indisch Es ist ein Metall, das zu Gruppe 13 des Periodensystems gehört und ein chemisches Symbol in hat. Ihre Atomnummer ist 49, 49In und wird in der Natur als zwei Isotope präsentiert: 113In und 115Letzteres ist am häufigsten am häufigsten. Auf der Erde werden indische Atome als Verunreinigungen in Zink- und Bleimineralien gefunden.
Es ist ein bestimmtes Metall, da es das weichste ist, das ohne viele Gesundheitsrisiken berührt werden kann. Im Gegensatz zu Lithium und Rubidium, die die Haut schrecklich verbrennen würden, wenn sie mit seiner Feuchtigkeit reagiert. Ein Stück Inder kann mit einem Messer und einer Fraktur mit der Kraft der Finger geschnitten werden, wodurch eine charakteristische Knusprigkeit abgibt.
Wer von diesem Metall hört, wird sich sicherlich in Indien einkommen, aber sein Name ergibt. In diesem Sinne sieht es ziemlich viel Kalium aus und verbrennt sein Metall oder seine Verbindungen mit einer sehr charakteristischen Flamme, durch die der Inder erstmals in Sphenset -Mineralien nachgewiesen wurde.
Der Inder teilt viele chemische Eigenschaften mit Aluminium und Gallium, die in den meisten Verbindungen mit einer Oxidationszahl von +3 (in3+). Es kombiniert hervorragend mit Gallien, die Legierungen mit niedrigen Schmelzpunkten bilden, von denen einer der Galinstan ist.
Indische Anwendungen basieren auf der Auskleidung von Materialien mit ihren Legierungen, wodurch sie elektrische und flexible Leiter machen. Der Inder hat etwas Glas, um ihnen größere Glitzer zu gewähren und das Silber zu ersetzen. In der Welt der Technologie befindet sich der Inder auf den Touchscreens und LCD.
Entdeckung
1863 suchte der deutsche Chemiker Ferdinand Reich nach Spuren des Talio -Elements unter Verwendung der grünen Linie seines Emissionsspektrums in Cinc -Mineralien. Speziell Proben von Sphalerit (Zns) um Sachsen. Nach dem Toasten der Mineralien, entfernen Sie ihren Schwefelgehalt, verdauen Sie sie in Salzsäure und destillieren Sie das Zinkchlorid, erhalten einen Pajizo -Niederschlag.
Angesichts des Befundes entschied sich Reich für eine spektroskopische Analyse; Aber weil er keine guten Augen hatte, um die Farben zu beobachten, ging er zu seinem Kollegen Hariomus Theodor Richter, um ihm bei dieser Aufgabe zu helfen. Richter war derjenige, der eine bläuliche Spektrallinie beobachtete, die nicht mit dem Spektrum eines anderen Elements übereinstimmte.
Es kann Ihnen dienen: Jodosesäure (HIO2): Eigenschaften und VerwendungDie beiden deutschen Chemiker standen vor einem neuen Element, das als indische Farbe für die Indigo -Farbe der Flamme bezeichnet wurde, als ihre Verbindungen verbrannten; Und wiederum stammt der Name dieser Farbe aus dem lateinischen Wort Indikum, Was bedeutet Indien.
Ein Jahr später, im Jahr 1864, erregt und nach einer längeren Reihe von Niederschlägen und Reinigungen eine Probe metallischer Inder durch die Elektrolyse ihrer gelösten Salze in Wasser isoliert.
Indische Struktur
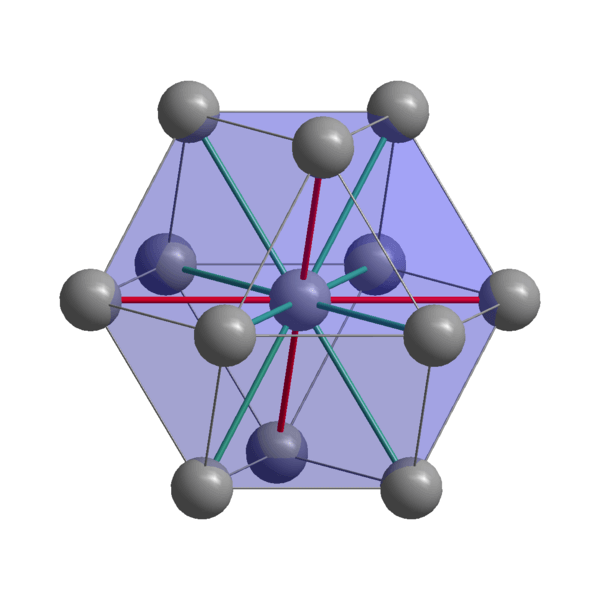 Indische kristalline Struktur
Indische kristalline Struktur Indianer, IN, Kohäsionsatome mit ihren Valenzelektronen, um eine Metallbindung herzustellen. So werden sie in einer verzerrten tetragonalen Struktur bestellt, die sich auf den Körper konzentriert. Die Wechselwirkungen zwischen den In-In-Nachbar-Atomen sind relativ schwach, was erklärt, warum der Inder einen niedrigen Schmelzpunkt (156 ° C) hat.
Andererseits sind die Kräfte, die zwei oder mehr indische Kristalle vereinen.
Indische Eigenschaften
Aussehen
Es ist ein bemerkenswert weiches Silbermetall. Es kann mit dem Druck des Nagels reißen, mit einem Messer geschnitten oder in hellen Strichen auf einem Blatt Papier kratzen. Es ist sogar möglich, es zu kauen und mit den Zähnen zu verformen, vorausgesetzt, es ist abgeflacht. Es ist auch sehr duktil und formbar, mit plastischen Eigenschaften.
Wenn der mit einer Taschenlampe erhitzte Indianer eine Flamme einer Indigofarbe entlässt, noch heller und farbener als die von Kalium.
Molmasse
114,81 g/mol
Schmelzpunkt
156,60 ºC
Siedepunkt
2072 ºC.
Wie der Gallien hat der Inder ein großes Temperaturintervall zwischen seinem Fusionspunkt und dem Kochen. Dies spiegelt die Tatsache wider, dass die In-In-In-In-Wechselwirkungen in der Flüssigkeit stärker sind als solche, die im Glas vorherrschen. Und deshalb ist es einfacher, einen Tropfen Indianer zu erhalten als ihre Dämpfe.
 Indischer Standort im Periodenzüchter. Quelle: Daniel Mayer oder GreatPatton Vectorization: Sushant Savla, CC BY-SA 3.0, über Wikimedia Commons
Indischer Standort im Periodenzüchter. Quelle: Daniel Mayer oder GreatPatton Vectorization: Sushant Savla, CC BY-SA 3.0, über Wikimedia Commons Dichte
Bei Raumtemperatur: 7,31 g/cm3
Direkt am Schmelzpunkt: 7,02 g/cm3
Elektronegativität
1,78 auf der Paulingskala
Ionisationsenergien
Erstens: 558,3 kJ/mol
Zweitens: 1820.7 kJ/mol
Dritter: 2704 kJ/mol
Wärmeleitfähigkeit
81,8 W/(m · k)
Elektrischer widerstand
83,7 nω · m
Mohs Härte
1.2. Es ist kaum ein bisschen schwieriger als Talk (nicht schwer verwirrend).
Reaktivität
Der Inder löst sich in Säuren auf, um Salze zu verursachen, löst sich jedoch nicht in alkalischen Lösungen auf, selbst mit heißem Kaliumhydroxid. Reagiert in direktem Kontakt mit Schwefel, Sauerstoff und Halogenen.
Kann Ihnen dienen: Verdünnung: Konzept, wie es gemacht wird, Beispiele, ÜbungenDer Inder ist relativ amphoterer, verhält sich aber eher als Basis als als Säure, da es seine leicht grundlegenden wässrigen Lösungen ist. Das in (oh)3 Es wird mit der Zugabe von mehr Alkalis wieder aufgenommen, die in (OH) invortrieren, Komplexe verursachen, in (OH)4-, Wie bei Aluminaten.
Elektronische Konfiguration
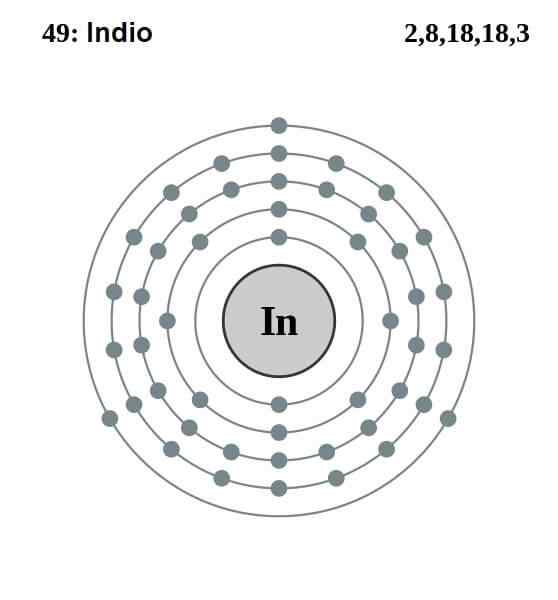 Elektronische indische Konfiguration
Elektronische indische Konfiguration Die elektronische Konfiguration des Inders lautet wie folgt:
[Kr] 4d10 5s2 5 p1
Von diesen dreizehn Elektronen sind die letzten drei der 5S- und 5p -Orbitale die von Valencia. Mit diesen drei elektronen indischen Atomen stellen indische Atome ihre Metallbindung her, wie es Aluminium und Gallium tut, und bilden kovalente Bindungen zu anderen Atomen.
Oxidationszahlen
Die oben genannten wird verwendet, um sofort zu stehen.
Wenn wir in einer Verbindung annehmen, dass es seine drei Elektronen verloren hat, bleibt es als dreifaches Kation in3+ (In Analogie al3+ und Ga3+) und daher beträgt Ihre Oxidationsnummer +3. Die meisten indischen Verbindungen sind in (III).
Unter anderem Oxidationszahlen für den Inder, den wir haben: -5 (in5-), -2 (in2-), -1 in-), +1 (in+) und +2 (in2+).
Einige Beispiele für Verbindungen in (i) sind: Inf, Inkl, Inbr, INI und In2ENTWEDER. Alle von ihnen sind relativ seltene Verbindungen, während die von in (iii) die vorherrschenden: in (OH) sind3, In2ENTWEDER3, Inkl3, Inf3, usw.
In (i) Verbindungen sind starke Reduktionsmittel, in denen das in+ Spenden Sie zwei Elektronen an andere Arten, um in zu werden3+.
Isotope
Der Inder wird in der Natur als zwei Isotope dargestellt: 113In und 115In, deren Landhäufigkeit 4,28% bzw. 95,72% beträgt. Daher haben wir auf Erden noch viel mehr Atome von 115In dem von 113In. Er 115In hat ein halbes Leben von 4,41 · 1014 Jahre, so groß, dass es praktisch als stabil angesehen wird, obwohl es ein Radioisotop ist.
Gegenwärtig wurden insgesamt 37 künstliche Isotope von Indianern, alle radioaktiv und sehr instabil. Von allen von ihnen ist das stabilste 111In, was ein halbes Leben von 2,8 Tagen hat.
Verwendet/Anwendungen
Legierungen
Der Inder versteht sich sehr gut mit dem Gallium. Beide Metalle bilden Legierungen, die mel. Außerdem ist der Inder leicht männlich und hat eine Löslichkeit von 57% in Quecksilber.
Kann Ihnen dienen: Essigsäure (CH3COOH)Indische Legierungen werden verwendet, um Silberspiegel zu entwerfen, ohne auf Silber zurückzugreifen. Wenn sie in einen Bereich von Material gegossen werden, wirkt es als haftbar, damit Glas, Metall, Quarz und Keramik gesammelt werden können.
Elektronik
 Ohne den Inder wären die Touchscreens nie existiert
Ohne den Inder wären die Touchscreens nie existiert Der Inder kommt ebenfalls mit Germanio aus, so dass seine Verbindungen als Doping in den germanischen Nitruro der LEDs hinzugefügt werden und diese Gemische blaue Lichter, lila und grün reproduzieren. Es ist auch Teil der Transistoren, Thermistoren und Photovoltaikzellen.
Das wichtigste seiner Verbindungen ist Zinn- und indisches Oxid, das als Glasfutter verwendet wird, um einige Wellenlängen widerzuspiegeln. Auf diese Weise können Sie in Schweißgläser und im Kratzglas verwendet werden, damit sie sich nicht im Inneren erhitzen.
Mit diesem Oxid überzogenes Glas sind gute Stromleiter. Wie der von unseren Fingern. Und deshalb ist es für die Herstellung von Touchscreens bestimmt, noch mehr aktuelle Aktivität aufgrund des Auftretens von immer mehr Smartphones.
Risiken
 Indianer im Festkörperstaat. Quelle: w. Oelen, CC BY-SA 3.0, über Wikimedia Commons
Indianer im Festkörperstaat. Quelle: w. Oelen, CC BY-SA 3.0, über Wikimedia Commons Der Inder stellt in erster Linie kein Risiko für die Umwelt dar, da es in Ionen in Ionen ist3+ Sie sind nicht in nennenswerten Mengen verbreitet. Es gibt keine Informationen darüber, wie sich die Auswirkungen auf die Böden auswirken würden, die Pflanzen betreffen, und weder in Fauna noch in Meeren.
Im Körper ist es unbekannt, ob die Ionen in3+ Sie haben eine wesentliche Teilnahme am Stoffwechsel in Spurenmengen. Wenn ihre Verbindungen jedoch aufgenommen werden, sind sie für mehrere Organe schädlich, weshalb sie als hochgiftige Substanzen angesehen werden.
Tatsächlich ITO -Partikel (Zinn und indisches Oxid für sein Akronym in Englisch: Indiumzinnoxid)), unverzichtbar für die Herstellung von Bildschirmen für Computer und Smartphones, sie können sich negativ auf die Gesundheit der Arbeitnehmer auswirken, was ihnen eine Krankheit namens Indian Lungen verursacht.
Die Aufnahme dieser Partikel erfolgt vor allem durch Einatmen und durch Kontakt durch Haut und Augen.
Andererseits sind feine metallische indische Partikel anfällig für Brennen und verursachen Brände, wenn es sich um Zäune einer Wärmequelle handelt.

