Immunglobulin M (IgM)
- 1705
- 25
- Rieke Scheer
Was ist Immunglobulin m?
Der Immunglobulin m entweder IgM Es ist ein Antikörper, der von B -Zellen oder Lymphozyten des Immunsystems vieler Tiere produziert wird. Es kann mit der Plasmamembran dieser Zellen verbunden oder in Form eines Komplexes gegenüber dem Blutkreislauf und der Lymphe sekretiert werden, sodass es aktiv an den Prozessen humoraler oder adaptiver Immunität beteiligt ist.
Sowie die anderen Immunglobuline (IgG, IGA, IGD und IGE), Immunglobulin M haben eine Struktur, sodass es in der Lage ist, jeder Art von Antigen, einschließlich Proteinen, Glykoproteinen, Polysacchariden und anderen Kohlenhydraten, Nuclecsäuren, Lipiden, unter Andere.
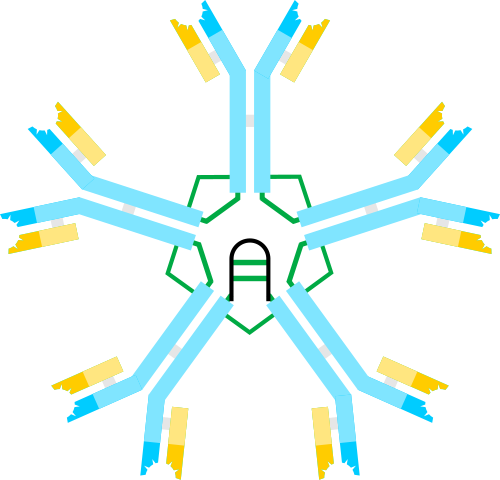
 Immunglobulin -M -Schema, ein Pentmer. Autor: Artur Jan Fijałkowski, Wikimedia Commons
Immunglobulin -M -Schema, ein Pentmer. Autor: Artur Jan Fijałkowski, Wikimedia Commons IgM ist eine der ersten Antikörper, die im Verlauf einer bakteriellen Infektion und während der Neugeborenenentwicklung produziert werden.
Er war der erste, der sich mit einer erheblichen Homogenität reinigte, und da es sich um einen polyreaktiven Antikörper handelt, hat er die Fähigkeit, zwei oder mehr Antigene gleichzeitig anzuschließen, selbst wenn sie unterschiedlich sind, ist es sehr wichtig für den Kampf verschiedener Pathologien.
Als "natürliche Antikörper", dh diejenigen, die ohne absichtliche vorherige Impfung auftreten.
IgM -Struktur
Ähnlich wie für Immunglobulin g, einem der am häufigsten vorkommenden Antikörper im Blutplasma, und anderen Immunglobulinen, Immunglobulinmonomeren M, haben eine Struktur, die wie in Form von "y" beschrieben werden kann Plasma als Pentamer.
Jede der 5 Untereinheiten dieses Penthamerikglykoproteins wird von vier Ketten gebildet: zwei identische schwere Ketten „μ“ von 55 kDa und zwei identische leichte Ketten von 25 kDa, die, wenn sie in der löslichen Pentamerform assoziiert ist, etwa 970 kDa wiegt.
Kann Ihnen dienen: Hautatmung: Eigenschaften und Beispiele von TierenLeichte Ketten werden dank der Bildung von Disulfidbrücken zwischen Cysteinabfällen nur zu einem Teil schwerer Ketten verbunden.
Wenn diese Moleküle enzymatisch hydrolysiert sind, führt diese Reaktion in zwei Fragmenten, von denen einer „homogen“, bekannt als konstanter Bereich oder FC, und der andere als variabler Region oder FAB2 (auch als hypervariabler Region bezeichnet), die in der Lage sind, sich zu verbinden Ein Antigen.
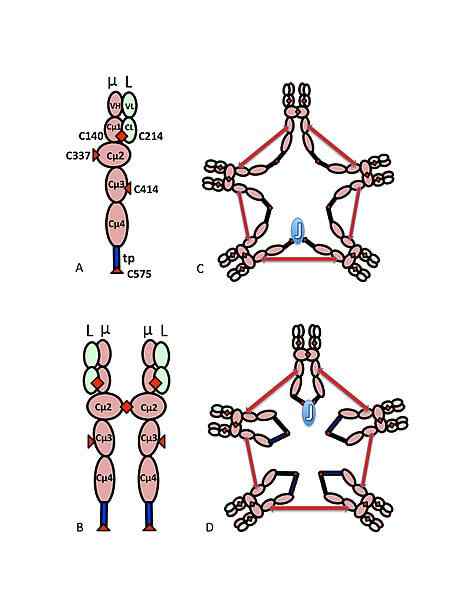 Schematisches Modell des IgM. Quelle: Marc Shulman, CC BY-SA 4.0, über Wikimedia Commons
Schematisches Modell des IgM. Quelle: Marc Shulman, CC BY-SA 4.0, über Wikimedia Commons Die Aminosäuresequenz der schweren Kette von Immunglobulin M, insbesondere der der konstanten Region, definiert ihre Identität und definiert die der anderen Antikörper -Isotypen, die bei Tieren definiert wurden, die gemeinsam die Superfamilie von Immunglobulinen ausmachen.
Die tertiäre Struktur der schweren und leichten Ketten dieses Antikörpers besteht aus β-plattierten Blättern, die durch bindelige Bindungen mit variabler Länge verbunden sind, die durch Disulfidbrücken stabilisiert werden können.
In der Pentamérica -Form interagiert jedes IgM -Monomer mit einer Polypeptidkette namens JDA -Kette und ermöglicht die Bildung der von den 5 Monomeren gebildeten Struktur.
Da jedes Monomer die Fähigkeit hat, sich zwei identischen Antigenmolekülen anzuschließen, kann ein IgM Pentamer gleichzeitig 10 Antigene beitreten.
Funktionen
Immunglobulin M beteiligt sich an der anfänglichen Reaktion gegen bakterielle Antigene, so dass es normalerweise der erste Antikörper ist.
Da seine lösliche Struktur in der Lage ist, eine große Anzahl von Antigenmolekülen zu verbinden, kann sie Antigenpartikel hinzufügen oder agglutinieren, die zu Zellen wie roten Blutkörperchen, Bakterien, Protozoen und anderen gehören.
Kann Ihnen dienen: Gap AnionDieser Antikörper ist sehr wichtig für die frühzeitige Neutralisation von Bakterientoxinen und auch bei der Vermittlung der Komplementsystemaktivität wirksam, was die schnelle "Opsonisierung" von Antigenpartikeln fördert.
 Grafische Darstellung von Immunglobulin m, die mit antigenen Epitopen von invasiven Bakterien verbunden sind (Quelle: SA1590 [CC BY-S (https: // kreative.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Grafische Darstellung von Immunglobulin m, die mit antigenen Epitopen von invasiven Bakterien verbunden sind (Quelle: SA1590 [CC BY-S (https: // kreative.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Seine monomere Form ist im Allgemeinen mit der Plasmamembran der „jungfräulichen“ B -Lymphozyten sowie mit Immunglobulin D verbunden, und es wurde festgestellt, dass ein Groß.
Es ist auch notwendig, die Tatsache hervorzuheben, dass es das erste Immunglobulin ist, das von „jungfräulichen“ B -Zellen in Feten während der Schwangerschaft nach den ersten Antigenstimulationen produziert wird.
Obwohl in geringer Konzentration, wurde Inimunoglobulin m in den Sekreten von Säugetieren gefunden, eine Tatsache, die darauf hindeutet, dass es auch am Immunschutz von Körperschleimhaut beteiligt ist.
Hohe Werte (Bedeutung) von IgM
Es wird angenommen, dass eine Person hohe Werte eines Immunglobulins aufweist, wenn Studien Werte über dem normalen Bereich zeigen.
Hohe Werte von masmetischem Immunglobulin können auf die jüngste Exposition gegenüber einem Antigen sowie auf ein frühes Stadium der viralen Hepatitis und anderer pathologischer Erkrankungen hinweisen, wie z. B.:
- Mononukleose,
- rheumatoide Arthritis,
- Waldestrom -Makroglobulinämie,
- nephrotisches Syndrom (Nierenschaden)
- Entwicklung von Infektionen durch parasitäre Wirkstoffe
Ein weiterer Grund, warum im Serum hohe IgM -Werte erhalten werden können, ist die Existenz von "Hyper IgM" -Syndromen (HIGM). Patienten mit diesem Syndrom sind anfälliger für das Leiden wiederkehrender Infektionen und sogar für verschiedene Krebsarten, da es mit einem drastischen Abfall der IgG -Spiegel dauert.
Kann Ihnen dienen: Analoge Organe: Konzept, Evolution, Eigenschaften und BeispieleNiedrige Werte (Bedeutung)
Die Existenz einiger signifikanter Pathologien wie mehrerer Myelome, einigen Arten von Leukämie und bestimmten erblichen Immunkrankheiten wurden mit niedrigen Immunglobulin -M -Spiegeln im Serum im Serum korreliert.
Patienten mit dem Mangel-Syndrom, die mit dem X Wiskott-Aldrich-Chromosom verbunden sind.
Niedrige IgM -Spiegel können auf schwerwiegendere Erkrankungen wie einen Immunglobulinmangel hinweisen, was schwerwiegende gesundheitliche Auswirkungen haben kann, insbesondere während der Exposition gegenüber neuen Antigenen oder im Verlauf bestimmter Krankheiten.
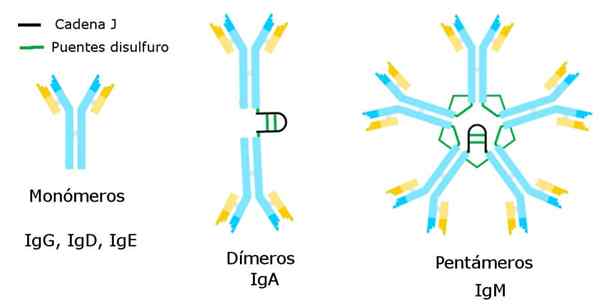 Arten von Immunglobulinen. Quelle: Alejandro Porto, CC BY-SA 3.0, über Wikimedia Commons
Arten von Immunglobulinen. Quelle: Alejandro Porto, CC BY-SA 3.0, über Wikimedia Commons Diese Mängel können viele Ursachen haben, von Fehlern in Antigenerkennungssystemen bis hin zu Defekten bei der Herstellung von Antikörpern durch Lymphozyten B.
Bei Patienten mit selektiven IGM -Mängeln wurden Spiegel von nur 40 mg/dl berichtet, die aus einer "seltenen" Form von Dysgammaglobulinämie bestehen.
Normalwerte
Der normale Plasmakonzentrationsbereich von Immunglobulin M ist äußerst variabel und hängt unter vielen Dingen vom Alter ab. Nach den verschiedenen Altersgruppen befindet sich dieser Antikörper in einer Konzentration von:
- 26-122 mg/dl zwischen 0 und 5 Monaten
- 32-132 mg/dl zwischen 5 und 9 Monaten
- 40-143 mg/dl zwischen 9 und 15 Monaten
- 46-152 mg/dl zwischen 15 und 24 Monaten
- 37-184 mg/dl zwischen 2 und 4 Jahren
- 27-224 mg/dl zwischen 4 und 7 Jahren
- 35-251 mg/dl zwischen 7 und 10 Jahren
- 41-255 mg/dl zwischen 10 und 13 Jahren
- 45-244 mg/dl zwischen 13 und 16 Jahren
- 49-201 mg/dl zwischen 16 und 18 Jahren
- 37-286 mg/dl bei Erwachsenen über 18 Jahre, obwohl einige Texte angeben, dass der Bereich zwischen 45 und 150 mg/dl, zwischen 45 und 250 mg/dl oder zwischen 60 und 360 mg/dl liegt
Es ist wichtig zu erwähnen, dass diese IgM -Konzentrationswerte mehr oder weniger 10 -mal weniger sind als die von anderen wichtigen Immunglobulinen wie zum Beispiel IgG.
- « Die 18 besten Mythen in Mexiko (Götter und Tiere)
- 17 Umweltprobleme in sehr schwerwiegendem Mexiko »

