Immunglobuline
- 1020
- 89
- Luca Holdt
 Illustration von Immunglobulinen
Illustration von Immunglobulinen Was sind Immunglobuline?
Der Immunglobuline Sie sind Moleküle, die B -Lymphozyten und Plasmazellen herstellen, die mit der Verteidigung des Organismus zusammenarbeiten. Sie bestehen aus einem Glykoprotein -Biomolekül, das zum Immunsystem gehört. Sie sind eines der am häufigsten vorkommenden Proteine des Blutserums, nach Albumin.
Antikörper ist ein anderer Name, den Immunglobuline erhalten und aufgrund ihres Verhaltens bei der Elektrophorese des Blutserums, das sie enthält. Das Immunglobulinmolekül kann einfach oder komplex sein, je nachdem, ob Ihre Präsentation als Monomer ist oder polymerisiert ist.
Die gemeinsame Struktur von Immunglobulinen ähnelt dem Buchstaben "Y". Es gibt fünf Arten von Immunglobulinen, die morphologische, funktionelle und Standortunterschiede im Körper haben. Die strukturellen Unterschiede der Antikörper sind nicht in Form, sondern in Bezug auf ihre Zusammensetzung; Jeder Typ hat ein bestimmtes Ziel.
Die von Immunglobulinen geförderte Immunantwort ist sehr spezifisch und ein hochkomplexer Mechanismus. Der Stimulus für seine Sekretion durch Zellen wird in Gegenwart seltsamer Mittel am Körper aktiviert, wie z. B. ein Bakterium. Die Funktion von Immunglobulin wird darin bestehen, sich dem seltsamen Element anzuschließen und es zu beseitigen.
Immunglobuline oder Antikörper können sowohl im Blut als auch auf der membranösen Oberfläche der Organe vorhanden sein. Diese Biomoleküle repräsentieren wichtige Elemente innerhalb des Systems des menschlichen Körpers.
Struktur von Immunglobulinen

Die Antikörperstruktur enthält Aminosäuren und Kohlenhydrate, Oligosaccharide. Das vorherrschende Vorhandensein von Aminosäuren, seine Menge und Verteilung bestimmt die Struktur von Immunglobulin.
Immunoglobuline haben wie jedes Protein eine primäre, sekundäre, tertiäre und quaternäre Struktur, was ihr typisches Aussehen bestimmt.
In Reaktion auf die Anzahl der amonierenden Aminosäuren haben Immunglobuline zwei Arten von Ketten: Schwerkette und leichte Kette. Darüber hinaus hat jede der Ketten gemäß der Aminosäuresequenz in seiner Struktur eine variable Region und eine konstante Region.
Schwere Ketten
Die schweren Ketten von Immunglobulinen entsprechen Polypeptideinheiten, die aus 440 Aminosäuresequenzen bestehen.
Jedes Immunglobulin hat 2 schwere Ketten, und jedes dieser Teil. Die konstante Region hat 330 Aminosäuren und die Variablen 110 Aminosäuren sequenziert.
Die Struktur der schweren Kette ist für jedes Immunglobulin unterschiedlich. Sie sind insgesamt 5 Arten von schwerer Kette, die die Arten von Immunglobulin bestimmen.
Schwerkettenarten werden mit den griechischen Buchstaben γ, μ, α, ε, δ für IgG, IgM, IgA, IgE und IGD -Immunglobuline identifiziert.
Die konstante Region von schweren Ketten ε und μ wird durch vier Domänen gebildet, während diejenigen, die α, γ, δ entsprechen. Dann unterscheidet sich jede konstante Region für jede Art von Immunoglobulin, aber im Immunoglobuline desselben Typs häufig.
Kann Ihnen dienen: Sternocleidohioid -MuskelDie variable Region der schweren Kette wird durch eine einzige Domäne von Immunglobulin gebildet. Diese Region hat eine Sequenz von 110 Aminosäuren und wird je nach Spezifität des Antikörpers durch ein Antigen unterschiedlich sein.
In der Struktur der schweren Ketten kann eine Angulation oder Flexion beobachtet werden - ein Scharnier -, das den flexiblen Bereich der Kette darstellt.
Lichtketten
Die Lichtketten von Immunglobulinen sind Polypeptide, die aus etwa 220 Aminosäuren bestehen. Es gibt zwei Arten von leichter Kette im Menschen: Kappa (κ) und Lambda (λ), letztere mit vier Subtypen. Die konstanten und variablen Domänen haben jeweils Sequenzen von jeweils 110 Aminosäuren.
Ein Antikörper kann zwei Lichtketten κ (κ & kgr;) oder ein Paar λ -Ketten (λλ) haben, aber es ist nicht möglich, gleichzeitig einen einzelnen Typ zu besitzen.
FC- und fabelhafte Segmente
Da jedes Immunglobulin eine ähnliche Form wie "Y" hat, kann in zwei Segmente unterteilt werden. Das "untere" Segment, die Basis, wird als kristallisierbarer Fraktion oder FC bezeichnet. während die Arme der "Y" die Fabrik oder die Fraktion bilden, die das Antigen vereint. Jede dieser strukturellen Abschnitte von Immunglobulin erbringt eine andere Funktion.
FC -Segment
Das FC -Segment hat zwei oder drei konstante Domänen der schweren Ketten von Immunglobulin.
FC kann Proteine oder einen bestimmten Empfänger in Basophilen, Eosinophilen oder Gerstenzellen beitreten, sodass es die spezifische Immunantwort induziert, die das Antigen eliminiert. FC entspricht dem Carboxylende von Immunglobulin.
Fabelhaftes Segment
Das Bruch- oder fabelhafte Segment eines Antikörpers enthält neben den konstanten Domänen der schweren und leichten Ketten die variablen Domänen an ihren Enden.
Die konstante Domäne der schweren Kette setzt sich mit den Domänen des FC -Segments fort, das das Scharnier bildet. Es entspricht dem Amino-terminalen Ende von Immunglobulin.
Die Bedeutung des Fab -Segments ist, dass es die Vereinigung mit Antigenen, seltsamen und potenziell schädlichen Substanzen ermöglicht.
Die variablen Domänen jedes Immunglobulins garantieren ihre Spezifität durch ein bestimmtes Antigen; Diese Funktion ermöglicht sogar ihre Verwendung bei der Diagnose entzündlicher und infektiöser Krankheiten.
Arten von Immunglobulinen
 Von Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons
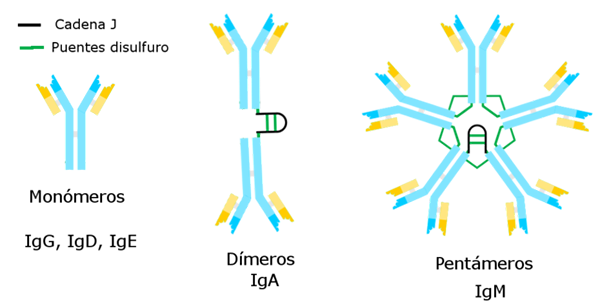
Von Alejandro Porto [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons Bisher bekannte Immunglobuline haben eine spezifische schwere Kette, die für jeden von diesen und den Unterschied zu den anderen konstant ist.
Es gibt fünf Arten von schweren Ketten, die fünf Arten von Immunglobulinen bestimmen, deren Funktionen unterschiedlich sind.
Immunglobulin (IgG)
Immunoglobulin G ist die zahlreichste Sorte. Es hat eine schwere Gamma -Kette und wird in einer unimolekularen oder monomeren Form präsentiert.
IgG ist sowohl im Blutserum als auch im Geweberaum am häufigsten am häufigsten. Mindeständerungen in der Aminosäuresequenz seiner schweren Kette bestimmen ihre Teilung in Subtypen: 1, 2, 3 und 4.
Kann Ihnen dienen: SarkomroImmunglobulin G hat eine Sequenz von 330 Aminosäuren in seinem FC -Segment und ein Molekulargewicht von 150.000, von denen 105.000 seiner schweren Kette entsprechen.
Immunglobulin M (IgM)
Immunglobulin M ist ein Pentage, dessen schwere Kette μ ist. Das Molekulargewicht ist hoch, ungefähr 900.000.
Die Aminosäuresequenz seiner schweren Kette beträgt 440 in ihrer FC -Fraktion. Es ist überwiegend im Blutserum und entspricht 10 bis 12 % der Immunglobuline. IgM hat einen einzelnen Subtyp.
Immunglobulin A (IGA)
Die schwere Kette α entspricht ihr und entspricht 15 % der gesamten Immunglobuline. IGA ist sowohl in Blut als auch in Sekreten, auch in der Muttermilch, vorhanden, die in Form eines Monomers oder Dimers dargestellt werden. Das Molekulargewicht dieses Immunglobulins beträgt 320.000 und hat zwei Subtypen: Iga1 und Iga2.
Immunglobulin E (IGE)
Immunglobulin E besteht aus dem schweren Kettentyp ε und ist im Serum sehr knapp, etwa 0,002 %.
IGE hat ein Molekulargewicht von 200.000 und ist als Monomer vor allem im Serum, Nasenschleim und Speichel vorhanden. Es ist auch üblich, dieses Immunglobulin in Basophilen und Mastzellen zu finden.
Immunglobulin D (IGD)
Die schwere Kettensorte δ entspricht Immunglobulin D, was 0,2 % der gesamten Immunglobuline entspricht. IGD hat ein Molekulargewicht von 180.000 und ist in Form eines Monomers strukturiert.
Es hängt mit B -Lymphozyten zusammen, die an der Oberfläche von diesen gebunden sind. Die Funktion des IGD ist jedoch nicht klar.
Typänderung
Immunoglobuline können aufgrund der Notwendigkeit einer Verteidigung gegen ein Antigen einen strukturellen Veränderungswechsel erleben.
Diese Änderung ist auf die Funktion von B -Lymphozyten von Herstellungsantikörpern durch adaptive Immunitätseigenschaft zurückzuführen. Die strukturelle Veränderung liegt im konstanten Bereich der schweren Kette, ohne die variable Region zu verändern.
Eine Klasse oder eine Klassenänderung kann dazu führen, dass ein IGM an IgG oder IGE übergeht, und dies tritt als induzierte Reaktion durch Gamma Interferon oder IL-4 und IL-5-Interleucine auf.
Funktionen von Immunglobulinen
Die Rolle von Immunglobulinen im Immunsystem ist für die Verteidigung des Organismus von entscheidender Bedeutung.
Immunglobuline sind Teil des humoralen Immunsystems; Das heißt, sie sind Substanzen, die von Zellen zum Schutz vor Krankheitserregern oder schädlichen Wirkstoffen ausgeschieden werden.
Sie bieten ein wirksames, effektives, spezifisches und systematisiertes Verteidigungsmittel, das als Teil des Immunsystems von großem Wert ist. Sie haben allgemeine und spezifische Funktionen innerhalb der Immunität:
Allgemeine Funktionen
Antikörper oder Immunglobuline erfüllen sowohl unabhängige Funktionen als auch aktivierende Effektor- und Sekretionsreaktionen, die durch Zellen vermittelt werden.
Antigen-Personal-Gewerkschaft
Immunoglobuline haben die Funktion, antigene Wirkstoffe speziell und selektiv zusammenzuarbeiten.
Die Bildung des Antigen-Antikörper-Komplexes ist die Hauptfunktion eines Immunglobulins und daher die Immunantwort, die die Antigenwirkung stoppen kann. Jeder Antikörper kann zwei oder mehr Antigene gleichzeitig verbinden.
Kann Ihnen dienen: AlveolarknochenEffektive Funktionen
Die meiste Zeit dient der Antigen-Antikörperkomplex als Anfang, um spezifische zelluläre Reaktionen zu aktivieren oder eine Folge von Ereignissen zu starten, die die Eliminierung des Antigens bestimmen. Die beiden häufigsten Effektorantworten sind die Aktivierung von Zellvereinigung und Komplement.
Die Zellvereinigung hängt vom Vorhandensein spezifischer Rezeptoren für das Immunglobulin -FC -Segment ab, sobald sie sich dem Antigen beigetreten hat.
Zellen wie Mastzellen, Eosinophile, Lymphozyten -Basophile und Phagozyten besitzen diese Rezeptoren und liefern Antigen -Eliminierungsmechanismen.
Die Aktivierung des Komplementwasserfalls ist ein komplexer Mechanismus, der den Beginn einer Sequenz beinhaltet. Daher ist das Endergebnis die Sekretion toxischer Substanzen, die Antigene eliminieren.
Spezifische Funktionen
Erstens entwickelt jede Art von Immunglobulin eine bestimmte Verteidigungsfunktion:
Immunglobulin g
- Immunoglobulin G liefert die meisten Abwehrkräfte gegen Antigenmittel, einschließlich Bakterien und Viren.
- IgG aktive Mechanismen wie Komplement und Phagozytose.
- Die spezifische IgG -Verfassung für ein Antigen ist langlebig.
- Der einzige Antikörper, den die Mutter während der Schwangerschaft zu Kindern übertragen kann.
Immunglobulin m
- IgM ist der schnelle Antikörper vor schädlichen und infektiösen Wirkstoffen, da sie sofortige Wirkung liefert, bis es durch das IgG ersetzt wird.
- Dieser Antikörper aktiviert zelluläre Reaktionen, die in die Membran von humoralen Lymphozyten und Reaktionen wie Komplement eingebaut sind.
- Es ist das erste Immunglobulin, das den Menschen synthetisiert.
Immunglobulin a
- Es fungiert als Verteidigungsbereich gegen Krankheitserreger, wenn es sich auf den Oberflächen der Schleimhäute befindet.
- Es ist in Atemschleimhaut, Verdauungssystem, Harnweg und auch in Sekreten wie Speichel, Nasenschleim und Tränen vorhanden.
- Obwohl seine Komplementaktivierung gering ist, kann sie mit der Glätte verbunden sein, um Bakterien zu beseitigen.
- Das Vorhandensein von Immunglobulin D sowohl in der Muttermilch als auch im Caloster ermöglicht es einem Neugeborenen, es während des Stillens zu erwerben.
Immunglobulin e
- Immunoglobulin und einen starken Abwehrmechanismus gegen Allergiethersteller, die produzieren.
- Die IGE -Wechselwirkung und ein Allergen werden entzündliche Substanzen für die Symptome von Allergien wie Niesen, Husten, Nesselsucht, Zunahme von Tränen und Nasenschleim verantwortlich machen.
- Das IgE kann auch durch sein FC -Segment an die Oberfläche der Parasiten gekoppelt werden, was eine Reaktion erzeugt, die den Tod dieser erzeugt.
Immunglobulin d
- Die monomere Struktur von IGD ist mit B -Lymphozyten verbunden, die nicht mit Antigenen interagiert haben, daher führen sie die Rezeptorfunktion aus.
- Die Funktion von IGD ist unklar.

