Hydrophobe Wechselwirkungen Was ist, Wichtigkeit, Beispiele
- 942
- 66
- Medine Kedzierski
Der Hydrophobe Wechselwirkungen (HI) Sie sind die Kräfte, die den Zusammenhalt zwischen apolaren Verbindungen aufrechterhalten, die in eine polare Lösung oder einen Lösungsmittel eingetaucht sind. Im Gegensatz zu anderen nichtkovalenten Wechselwirkungen wie Wasserstoffbrücken, ionischen Wechselwirkungen oder Van der Waals-Kräfte hängen hydrophobe Wechselwirkungen nicht von den intrinsischen Eigenschaften von gelösten gelösten, sondern von Lösungsmitteln ab.
Ein sehr illustratives Beispiel für diese Wechselwirkungen kann die Phasentrennung sein, die beim Mischen von Wasser mit Öl auftritt. In diesem Fall "interagieren" die Ölmoleküle infolge der Reihenfolge der Wassermoleküle um sie herum miteinander.
 Emulsion von Fett im Wasser (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons)
Emulsion von Fett im Wasser (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] aus Wikimedia Commons) Der Begriff dieser Interaktionen existiert seit den vierziger Jahren. Der Begriff "hydrophobe Verbindung" wurde jedoch 1959 von Kauzmann geprägt, während er die wichtigsten Faktoren bei der Stabilisierung der dreidimensionalen Struktur bestimmter Proteine untersuchte.
Er sind die wichtigsten unspezifischen Wechselwirkungen, die in biologischen Systemen stattfinden. Sie spielen auch eine wichtige Rolle in einer Vielzahl von technischen Anwendungen sowie in der chemischen und pharmazeutischen Industrie, die wir heute kennen, die wir heute kennen.
Ursache hydrophober Wechselwirkungen
Die physikalische Ursache von ihm basiert auf der Unfähigkeit apolarer Substanzen, Wasserstoffbrückenbindungen mit Wassermolekülen in einer Lösung zu bilden.
Sie sind als "unspezifische Wechselwirkungen" bekannt, da sie nicht mit der Affinität zwischen gelösten Molekülen verbunden sind, sondern mit der Tendenz von Wassermolekülen, ihre eigenen Wechselwirkungen mittels Wasserstoffbrückenbindungen aufrechtzuerhalten.
Kann Ihnen dienen: BiotensideNach dem Kontakt mit Wasser tendieren apolare oder hydrophobe Moleküle dazu, spontan hinzuzufügen, um eine größere Stabilität zu erzielen, indem die Kontaktfläche mit Wasser reduziert wird.
Dieser Effekt könnte mit einer starken Anziehung verwechselt werden, aber es ist nichts weiter als eine Folge des apolaren Charakters der Substanzen in Bezug auf das Lösungsmittel.
Aus thermodynamischer Sicht erklärt diese spontanen Assoziationen auf der Suche nach einem energisch günstigen Zustand, in dem Sie die geringste freie Energievariation haben (∆G).
Berücksichtigt, dass ∆G = ∆H - T∆S, Der energisch günstigste Zustand wird derjenige sein, bei dem Entropie (∆S) Seien.
Wenn apolare Moleküle miteinander assoziiert sind und durch Wassermoleküle erzwungen werden, wird ein günstigerer Zustand erhalten, als wenn diese Moleküle getrennt blieben, die jeweils von einem „Käfig“ verschiedener Wassermoleküle umgeben sind.
Biologische Bedeutung
Seine haben große Relevanz, da sie in der Vielfalt biochemischer Prozesse auftreten.
Zu diesen Prozessen gehören die Konformationsänderungen in Proteinen, die Vereinigung von Enzymsubstraten, die Assoziation von Untereinheiten enzymatischer Komplexe, die Aggregation und Bildung biologischer Membranen, die Stabilisierung von Proteinen in wässrigen Lösungen und anderen.
In quantitativen Begriffen haben verschiedene Autoren die Aufgabe gegeben, zu bestimmen, wie wichtig seine Stabilität der Struktur großer Proteinmengen ist, und schließt zu dem Schluss, dass diese Wechselwirkungen zu mehr als 50 % beitragen.
Es kann Ihnen dienen: Oxidase -Glukose: Eigenschaften, Struktur, FunktionenViele Membranproteine (integral und periphere) sind dank HI mit Lipiddoppelschichten verbunden, wenn in ihren Strukturen diese Proteine hydrophobe Domänen haben. Darüber hinaus hängt die Stabilität der Tertiärstruktur vieler löslicher Proteine von HI ab.
Einige Techniken in der Untersuchung der Zellbiologie nutzen die Eigenschaft, die einige ionische Reinigungsmittel posieren.
Mischungen werden auch in pharmazeutischen Studien verwendet, die die Abgabe von fettlöslichen Arzneimitteln beinhalten, und ihre Bildung ist auch für die Absorption komplexer Vitamine und Lipide im menschlichen Körper wesentlich.
Beispiele für hydrophobe Wechselwirkungen
Membranen
Ein hervorragendes Beispiel für HI ist die Bildung von Zellmembranen. Solche Strukturen bestehen aus einer Doppelschicht von Phospholipiden. Ihre Organisation wird dank der HISS gegeben, die zwischen apolaren Schwänzen in der "Abstoßung" zur umgebenden wässrigen Umgebung auftreten.
Proteine
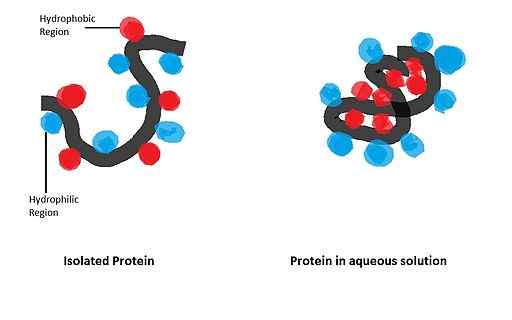
Er hat einen großen Einfluss auf die Faltung von kugelförmigen Proteinen, deren biologisch aktive Form nach der Festlegung einer bestimmten räumlichen Konfiguration erhalten wird, die durch das Vorhandensein bestimmter Aminosäureabfälle in der Struktur bestimmt wird.
- Der Fall von Apomioglobin
Apomicoglobin (Myoglobin ohne die Hämogruppe) ist ein kleines alpha-helikoidales Protein, das als Modell für die Untersuchung des Faltprozesses und der Bedeutung seines unter den apolaren Abfällen in der Polypeptidkette derselben gedient hat.
In einer Studie von Dyson und Mitarbeitern im Jahr 2006, in der mutierte Sequenzen von Apomioglobin verwendet wurden.
Es kann Ihnen dienen: Beziehung zwischen Materie und Energie, die in der Zellernährung beobachtet wirdSomit sind kleine Veränderungen, die in der Aminosäuresequenz eingeführt werden.
Reinigungsmittel
Ein weiteres klares Beispiel dafür ist die Wirkungsweise kommerzieller Reinigungsmittel, die wir jeden Tag für häusliche Zwecke verwenden.
Detergenzien sind amphipatische Moleküle (mit einer polaren Region und einem anderen apolaren). Sie können Fett "emulgieren", da sie die Fähigkeit haben, Wasserstoffbrückenbindungen mit Wassermolekülen zu bilden und hydrophobe Wechselwirkungen mit den in Fetten vorhandenen Lipiden aufweisen.
Nach dem Kontakt mit Fett in eine wässrige Lösung sind die Waschmittelmoleküle so assoziiert, dass die apolaren Schwänze die Lipidmoleküle umgeben und der Oberfläche der Mycela ausgesetzt sind, die in Wasserkontakt eindringen, die in Wasserkontakt gelangen.
Verweise
- Chandler, d. (2005). Grenzflächen und die treibende Kraft des hydrophoben Ansammlung. Natur, 437(7059), 640-647.
- Dyson, J. H., Wright, p. UND., & Sheraga, h. ZU. (2006). Die Rolle hydrophober Wechselwirkungen bei der Initiierung und Ausbreitung der Proteinfaltung. PNAs, 103(35), 13057-13061.

