Hydronio -Ion
- 1728
- 209
- Timo Rabenstein
Was ist das Hydroniumionen?
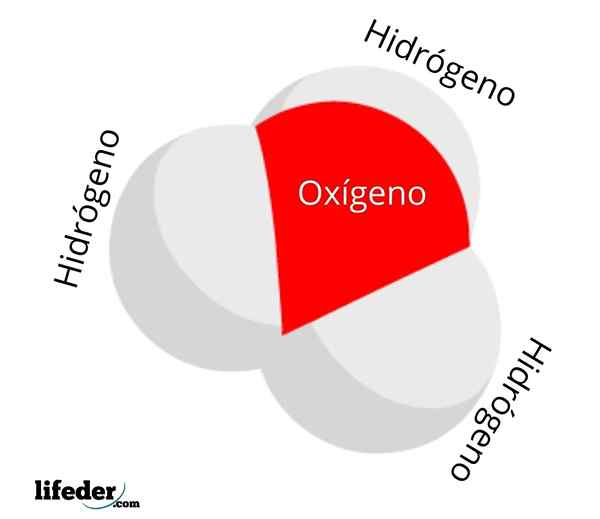
Er Hydronio -Ion Es ist eine Art positive Belastung, die sich aus der Protonierung eines Wassermoleküls ergibt und deren chemische Formel H ist3ENTWEDER+. Es besteht aus den einfachsten Oxonianern: Ionen, bei denen Sauerstoff eine positive formelle Belastung trägt und drei kovalente Bindungen aufweist.
Die h3ENTWEDER+ Es ist eines der einfachsten, aber neugierigen Kationen, die existieren. In Wasser unter normalen Bedingungen hat es eine Konzentration von 1 · 10-7 M, Produkt des Selbstvergütungsbetriebs. Die Konzentration nimmt jedoch exponentiell zu, wenn sie stark sind3ENTWEDER+ Sie lösen sich im Wasser auf und säuern Sie es.
 Hydroniumionenmolekül
Hydroniumionenmolekül Die Konzentration oder Aktivität von H3ENTWEDER+ Im Wasser dient es dazu, die Säure der wässrigen Lösungen zu messen: PH. Je mehr H -Ionen3ENTWEDER+ Heu, weniger positiv wird pH und mehr Säure wird die fragliche Lösung sein. Diese Säure hingegen liegt im Wasserstoffionen, h+, was oft mit Ion H verwirrt ist3ENTWEDER+.
 Ionen- oder Hydronio -Kation -Formel
Ionen- oder Hydronio -Kation -Formel Die h+ und seine erstaunliche Fähigkeit, zwischen den Wasserstoffbrücken der Wassermoleküle zu transportieren3ENTWEDER+ assoziieren in komplexeren Kationenformationen; wie Eigenkation, h9ENTWEDER4+, und Zundels Kation, h5ENTWEDER2+, und viele andere.
Hydroniumionenstruktur
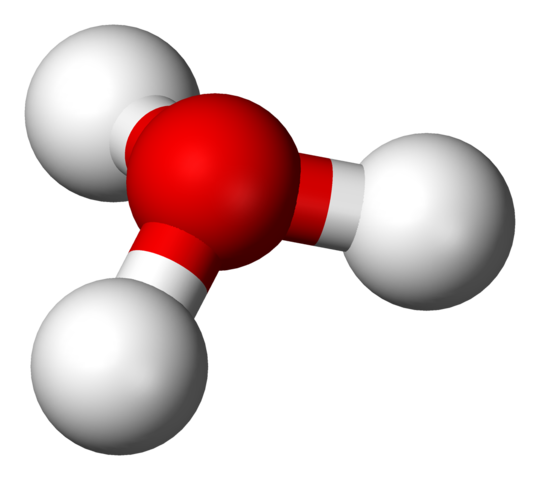 H3O+ Struktur mit einem Kugeln und Balkenmodell
H3O+ Struktur mit einem Kugeln und Balkenmodell Im ersten Bild konnten Sie die strukturelle Formel des Hydriumion sehen. Jetzt sehen wir seine Darstellung mit einem Kugeln und Bars -Modell. In beiden Highlights ist die trigonale Pyramidengeometrie, deren Verbindungswinkel (O-H) 113º beträgt; Ein wenig von 119º für das Tetraeder umgeleitet.
Obwohl Sauerstoff eine positive Teilbelastung aufweist, bedeutet dies nicht, dass sich die negative Region um Wasserstoffatome befindet. Andererseits. Sauerstoff in h3ENTWEDER+ Es ist noch mehr elektronegatives Produkt seines elektronischen Mangels. Die gesamte negative Dichte, die auf einer elektrostatischen Potentialkarte sichtbar gemacht hat:
Kann Ihnen dienen: Kaliumsulfat (K2SO4): Struktur, Eigenschaften, Verwendungszwecke, Synthese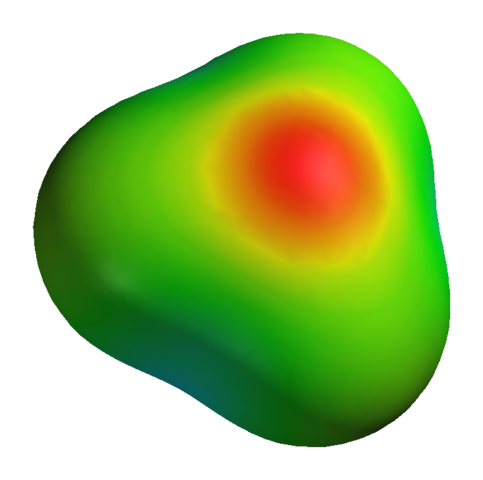 Elektrostatische Potentialkarte für H3O+
Elektrostatische Potentialkarte für H3O+ Ganz zu schweigen davon.
Eine Folge all der oben genannten ist, dass H -Hydrogene3ENTWEDER+ Sie verlieren die elektronische Dichte, weil Sauerstoff ihn zu sich selbst anzieht. Daher h3ENTWEDER+ Sie können sehr starke Wasserstoffquellen mit einem benachbarten Wassermolekül herstellen: H2ENTWEDER+-H-oh2.
Diese Interaktion ist der Schlüssel für die erstaunliche ionische Mobilität von H+ und warum h3ENTWEDER+ Es kann gleichzeitig mit vielen Wassermolekülen in Verbindung gebracht werden.
Säure
Hydronio -Ion ist eine sehr starke Säure. Tatsächlich ist es die stärkste Säure, die in wässriger Lösung existieren kann. Weil? Weil jede andere Säure, die stärker ist als er3ENTWEDER+:
Ha + h2O → a- + H3ENTWEDER+
Die h3ENTWEDER+ Es ist in der Lage, stabil zu bleiben, wenn es keine anderen Grundlagen in der Umgebung gibt, die stärker sind als Wasser. Jede Säure hat eingehalten, dass dies als starke Säure klassifiziert wird. In der Zwischenzeit, wenn die Säure schwächer ist als h3ENTWEDER+, Dann wird ein Teil von HA nicht vollständig dissoziiert und wir werden über eine schwache Säure sprechen:
Ha + h2Oder ⇌ a- + H3ENTWEDER+
Daher seit h3ENTWEDER+ Es ist die stärkste Säure, die im Wasser existiert, der Säure davon hängt von der Konzentration von H ab3ENTWEDER+. Dies ist die Grundlage, um einfache Weise die Säure einer wässrigen Lösung zu definieren, die als pH ausgedrückt wird:
ph = -log [h3ENTWEDER+]
H+ vs. H3ENTWEDER+
Wasserstoffionen und Hydronium sind nicht gleich. Die h+ Es ist viel saurer als h3ENTWEDER+, Nun, es besteht aus einem Protoner Nichts mehr, das nach einem Molekül sucht, um Elektronen auf alle Weise zu gewinnen. Wenn H+ Holen Sie sich ein Wassermolekül bildet h3ENTWEDER+:
Es kann Ihnen dienen: CUPRIC OXID (CUO)H+ + H2O → h3ENTWEDER+
Deshalb h h3ENTWEDER+ kann als h dargestellt werden+(AC), was darauf hinweist, dass es ein h ist+ In wässrigem Medium.
Die Kraft einer Säure wird in ihrer Spendenfähigkeit gemäß der Definition von Brönsted-Lowry, H-Ionen, gemessen+. Wie viel stärker es ist, desto mehr wird es spenden+, Nein h3ENTWEDER+. Die stärksten Säuren, die jemals synthetisiert werden (Supercids)+ Er ist "nackt"; Das heißt, ohne irgendein Hindernis, in Richtung des Moleküls zu springen, das protonieren wird.
Die Praxis, h zu repräsentieren3ENTWEDER+ als h+.
Solvation
Die h3ENTWEDER+ Es kann sehr starke Wasserstoffbrücken mit einem benachbarten Wassermolekül bilden. Dabei haben wir das Kation von Zundel, h5ENTWEDER2+:
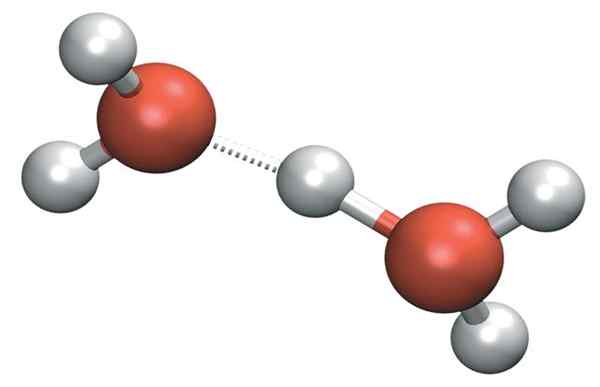 Zundel Kation
Zundel Kation Die positive Belastung bleibt jedoch nicht nur auf einer einzelnen Seite des Kation+:
H2Oh-+Oh2 → h2ENTWEDER+-H- Oh2
Daher wird die positive Belastung zwischen beiden Sauerstoffatomen für die beiden Wassermoleküle verteilt.
Im Fall des Eigenkation, h9ENTWEDER4+, und h3ENTWEDER+ Formatwasserstoffbrücken mit drei Wassermolekülen bilden und unter ihnen die positive Belastung dank eines „Sprung“ H verteilt+. Diese Sprünge sind so schnell, dass sie die große ionische Mobilität von H erklären+ In Wasser mit H3ENTWEDER+ als Fahrzeug und Wassermoleküle wie eine Autobahn.
Die h5ENTWEDER2+ und h9ENTWEDER4+ Sie sind nicht die einzigen kationischen Assoziationen, die h3ENTWEDER+ kann aus Wasser stammen. Einige molekulare Dynamikberechnungen zeigen die Existenz eines H -Clusters3ENTWEDER+(H2ENTWEDER)zwanzig: 20 h Moleküle2Oder mit einem H -Kation interagieren3ENTWEDER+ und unter ihnen die positive Last verteilen.
Kann Ihnen dienen: Neodymium: Struktur, Eigenschaften, verwendetDaher h3ENTWEDER+ und h+ Sie bauen eine merkwürdige Beziehung zu Wassermolekülen auf, die über Säure hinausgehen.
Du gehst raus
So wie organische Oxy -Räume existieren, ist es keine Ausnahme mit Oxy, die aus der Wasserprotonation abgeleitet ist. Seine allgemeine Formel ist [h3ENTWEDER+] [X-], Wo x- Es ist ein Anion, das aus der Auflösung einer sehr starken Säure kommt.
Diese Salze erhalten manchmal den Namen "Monohydratsäuren", da die Formel [h)3ENTWEDER+] [X-] oder h3ENTWEDER+· X- Es kann auch als hx · h geschrieben werden2ENTWEDER. Somit kann es Dihydratsäuren geben, Hx · 2H2Oder Trihydrate, hx · 3h2Oder usw.
Zum Beispiel kann HCl als HCl · h kristallisieren2OH3ENTWEDER+· Cl-. Wir haben auch andere Hydroniumsalze wie h3ENTWEDER+· Clo4- oder HCLO4· H2Oder, und hbr · 4h2OH3ENTWEDER+· Br-· 3h2ENTWEDER.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Shiver & Atkins. (2008). Inorgán ChemieICA. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Hydronium. Abgerufen von: in.Wikipedia.Org
- Avneet Kahlon & Stephen Lower. (15. August 2020). Das Hydroniumion. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Helmestine, Anne Marie, ph.D. (25. August 2020). Hydronium -Ionen -Definition. Erholt von: thoughtco.com
- Die Herausgeber von Enyclopaedia Britannica. (2020). Wasserstoffionen. Erholt von: Britannica.com

