Ionisation in Physik und Chemiekonzept, Prozess und Beispiele

- 1959
- 458
- Tizian Liebich
Der Ionisation Es ist alles der Prozess, bei dem elektrische Lasten aus neutralen Partikeln erzeugt werden. Dies kann durch verschiedene natürliche Mechanismen oder Kräfte erfolgen, entweder durch Strahlung, Wärme, elektrische Felder, Magnetfelder oder chemische Reaktionen. Ionen werden infolge.
Die Ionisation ist ein grundlegender Prozess für Symphine physikalischer, chemischer oder natürlicher Phänomene, wobei letztere eine Mischung aus physikalisch -chemischen Veränderungen ist. Zum Beispiel treten bei physikalischen Ionisationen im Prinzip chemische Reaktionen nicht auf; Das heißt, die Ionenproduktion bedeutet nicht die Aufschlüsselung oder Bildung neuer Links.
 Viele natürliche Phänomene wie Nordlichter basieren auf der Ionisierung von Atmosphärenmolekülen. Quelle: Pixabay.
Viele natürliche Phänomene wie Nordlichter basieren auf der Ionisierung von Atmosphärenmolekülen. Quelle: Pixabay. In natürlichen Phänomenen wird diese Ionisation jedoch normalerweise von chemischen Reaktionen begleitet, wie z. Auch während der Gewitter werden Stickoxide aufgrund der Strahlen und ihrer intensiven Temperaturen erzeugt, die den Stickstoff der Luft oxidieren.
Andererseits kann sich die Ionisation in das gleiche Wasser, im Reiben zwischen zwei Oberflächen, in den Oxidationen der Metalle oder bei der Auflösung bestimmter Gase in Wasser schleicht:.
[TOC]
Chemie -Ionisation
Oxidationsreduzierung
 Während des Betriebs der Batterien eines Spielzeugs sind Ionen und Elektronen kontinuierlich. Quelle: D J SHIN/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0)
Während des Betriebs der Batterien eines Spielzeugs sind Ionen und Elektronen kontinuierlich. Quelle: D J SHIN/CC BY-SA (https: // creativecommons.Org/lizenzen/by-sa/3.0) Bei der chemischen Ionisation werden Ionen durch Brechen oder Verbindungsbildung erzeugt. Zwei Substanzen verdienen oder verlieren Elektronen irreversibel: Derjenige, der die Elektronen verliert.
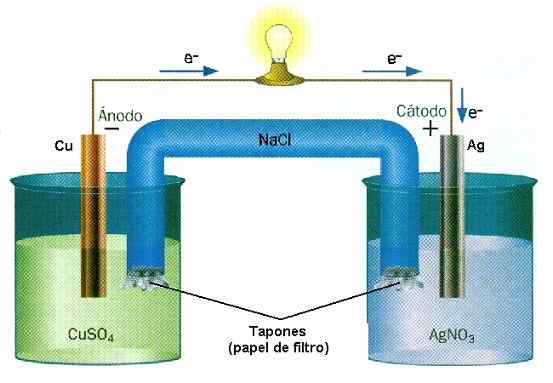
 Beispiel für eine Oxidreaktionsreduktion des Cu-Ag-Stapels. Quelle: Wasserwand/CC BY-SA (http: // CreePecommons.Org/lizenzen/by-sa/3.0/)
Beispiel für eine Oxidreaktionsreduktion des Cu-Ag-Stapels. Quelle: Wasserwand/CC BY-SA (http: // CreePecommons.Org/lizenzen/by-sa/3.0/) In den Batterien verliert eine Substanz Elektronen, während ein anderer sie gewinnt. Diese Elektronen reisen und aktivieren die elektrischen Schaltungen eines Geräts, um schließlich in ein zweites Pfahlabteil zurückzukehren, in dem die andere Substanz sie erwartet, um sie zu fangen und negativ zu laden. Dies ist ein Beispiel für eine chemische Ionisation, die durch eine Oxid-Reduktionsreaktion durchgeführt wird.
Kann Ihnen dienen: Gluconsäure: Struktur, Eigenschaften, Synthese, verwendetHeterolytischer Bruch
Eine andere Art der chemischen Ionisation ist auf heterolithische Bruch zurückzuführen. Wenn dieser Bruch auftritt, wird die A-B-Verbindung gebrochen, um die Ionen zu formen+ und B-, Weil die Elektronen auf das Atom gerichtet sind, für das sie eine größere Affinität "fühlen". Heterolithische Bruch ist normalerweise der erste Schritt, der die Mechanismen vieler organischer Reaktionen regiert.
Selfisation
Elektrische Lasten können nicht nur durch die Elektronenbewegung an sich auftreten, sondern auch durch die Links, die unterbrochen oder in einem Austausch von Atomen gebildet werden. Dies ist der Fall von Selbst -ISISISION, der zwischen zwei Molekülen derselben Verbindung auftritt.
Von allen chemischen Ionisationen ist Selbst -Iization die einfachste und nicht wahrnehmbare.
Ionisation in der Physik
Statische Elektrizität
 Das Haar dieses Mädchen. Quelle: BiseUp Ganguly/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0)
Das Haar dieses Mädchen. Quelle: BiseUp Ganguly/CC BY (https: // creativecommons.Org/lizenzen/bis/3.0) Die Ionisation ist auch sehr an physikalischen Phänomenen beteiligt. Im Allgemeinen bedeutet die Physikionisation keine chemischen Reaktionen. Die Atome der Materie werden elektrisch aufgeladen, ohne ihre ursprüngliche Identität zu verlieren.
Oberflächen können Elektronen austauschen, wenn sie sich an den Weitheit reiben, wenn einer von ihnen wirksamer speichert, was zu statischer Elektrizität führt. Es wird nicht mehr von Atomen gesprochen, sondern von einem ganzen Material, das eine negative oder positive Belastung erlang.
Gasöse Ionisation
Verteilte gasförmige Atome können Elektronen verlieren, wenn sie einem elektrischen Feld ausgesetzt sind. Dabei sind Atome aufgeregt und Elektronen freigesetzt. Dann, wenn sie abkühlen und zu ihrem Status als kleinere Energie zurückkehren, verabschieden sich die Photonen. Und der Vorgang wird immer wieder wiederholt. Das Ergebnis: eine Quelle für Beleuchtung oder Strom.
Kann Ihnen dienen: Boroxid (B2O3): Was ist, Struktur, Eigenschaften, verwendetIonisation Strahlung oder Kollisionen
In ähnlicher Weise kann Materie Energie gewinnen, die durch verschiedene Strahlungsarten bereitgestellt werden (Gamma, X -Strahlen, Ultraviolett usw.) oder durch Kollieren mit energiegeladenen Partikeln (Alfas, Betas und Neutronen).
Die Energie beiträgt so, dass ein Elektron des Atoms sofort ist. Diese Art der Ionisation hängt mit mehreren radioaktiven und kosmischen Phänomenen zusammen.
Wasserionisation
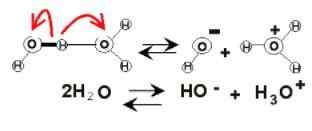 Wasserdissoziation
Wasserdissoziation Im Wasserbosom können elektrische Ladungen aufgrund ihrer Ionisierung auftreten. Dies ist die Chemikalie, da zwei Wassermoleküle plötzlich aufeinander reagieren, um die H -Ionen zu dissoziieren und zu erzeugen3ENTWEDER+ und oh-:
2H2Oder (l) ⇌ h3ENTWEDER+(Ac) + oh-(Ac)
Dieses Gleichgewicht wurde sehr in Richtung Wasser verschoben, so dass es kaum eine verabscheuungswürdige Menge dieser Ionen gibt.
Luftionisation
Luftmoleküle beteiligen sich nicht an einem Gleichgewicht der Selbst -Erisierung. Sauerstoff, Stickstoff, Argon, Wasserdampf und die anderen Gase, aus denen die Luft besteht, wechseln keine Atome oder Elektronen aus. Daher ist Luft unter normalen Bedingungen kein guter Stromleiter.
Wenn es jedoch einem elektrischen Feld, Strahlung oder intensiven Temperaturen ausgesetzt ist, kann es Ion sein und ein guter Fahrer werden. Dies passiert zum Beispiel, wenn elektrische Strahlen von Wolken auf die Erde fallen und Elektronen durch die Luft mit plötzlicher leichter Explosion fährt.
Ionisationsbeispiele
In den vorherigen Abschnitten wurden einige Ionisierungsbeispiele ernannt. Schließlich werden einige andere erwähnt.
Metalloxidation
Wenn Metalle oxidieren, entweder durch die Wirkung des Erdsauerstoffs oder durch den Angriff saurer Substanzen erwerben sie positive Ladungen, um Oxide bzw. Salze zu bilden.
Kann Ihnen dienen: Chemischer Prozess: Prinzipien, Typen, BeispieleZum Beispiel wird Eisen dank Sauerstoff ionisiert, um sich in Glaubenionen zu verwandeln3+, Befindet sich in Eisenoxidkristallen. Magnesium hingegen löst sich in Schwefelsäure auf, um Elektronen zu verlieren und als MG -Ionen zu bleiben2+ Im Magnesiumsulfatsalz.
Gase -Auflösung im Wasser
Einige Gase wie Ammoniak und Wasserstoffchlorid lösen sich in Wasser auf, um ihre Neutralität zu verlieren und die Ionenbildung hervorzurufen. Zum Beispiel Ammoniak, wenn es teilweise NH -Ionen auflöst4+ und oh-. In der Zwischenzeit produziert Wasserstoffchlorid beim Auflösen Hionen3ENTWEDER+ und Cl- vollständig.
Ein ähnlicher Fall ist die Auflösung von Salzen in Wasser wie Magnesiumsulfat, MGSO4. Mg Ionen jedoch2+ Und so42- Sie sind bereits an den Salzkristallen vorhanden, bevor sie sich im Wasser auflösen.
Beleuchtungslampen oder Röhrchen

In Dampflampen oder Beleuchtungsröhren werden gasförmige Atome mit elektrischen Stoßdämmen angeregt, um eine bestimmte Menge an Licht und Farben zu erzeugen. Zum Beispiel findet diese Ionisation in Natrium- oder Quecksilberlampen sowie in den berühmten Neonlichtern mit ihren leuchtenden Farben in Restaurant- oder Ladeneinträgen statt.
Ionisationsenergien
Ionisierungsenergie, eine periodische Eigenschaft, wird untersucht, um chemische Elemente nach der Leichtigkeit zu charakterisieren, mit der ihre gasförmigen Atome ihre Elektronen spenden, um positiv zu laden. So haben Metalle beispielsweise normalerweise die niedrigsten Ionisationsenergien, während nicht -metallische Elemente und edle Gase die höchsten.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Serway, r., Jewett, J. (2008). Physik für Wissenschaft und Ingenieurwesen. Band 1. 7. Auflage. Mexiko. Cengage Learning Editoren.
- Shiver & Atkins. (2008). Anorganische Chemie. (Vierte Edition). Mc Graw Hill.
- Wikipedia. (2020). Ionisation. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (17. Oktober 2016). Ionisation. Encyclopædia Britannica. Erholt von: Britannica.com
- Doug Stewart. (2018). Definition der Ionisierung: Was ist Ionisierung? Erholt von: Chemicoolool.com
- John Zavisa. (1. April 2020). Wie Blitz funktioniert. Erholt von: Wissenschaft.Howstuffwork.com
- « 18 Arten des Verhaltens und deren Eigenschaften (mit Beispielen)
- Yellow Liberalismus Herkunft, Eigenschaften, Ursachen, Folgen »

