Isóbaros
- 4716
- 538
- Nick Laurén
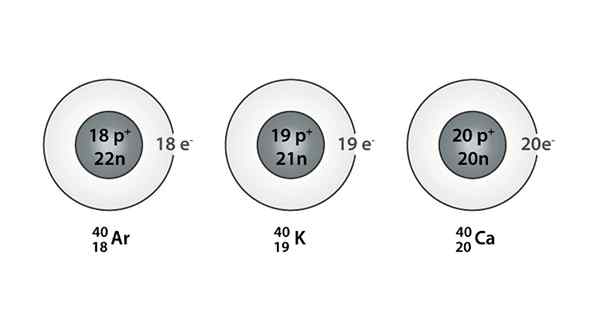
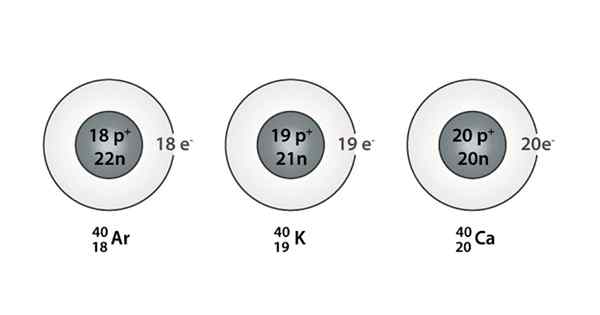 Beispiel für Isóbaro; Argon, Kalium und Kalzium, die Atome derselben Masse haben (40)
Beispiel für Isóbaro; Argon, Kalium und Kalzium, die Atome derselben Masse haben (40) Was sind die Isoparos??
Der Isóbaros Sie sind jene Atomarten, die die gleiche Masse haben, aber von verschiedenen chemischen Elementen stammen. Infolgedessen kann gesagt werden, dass sie aus unterschiedlichen Anzahl von Protonen und Neutronen bestehen.
Sowohl Protonen als auch Neutronen befinden sich im Kern ihrer Atome, aber die Nettomenge an Neutronen und Protonen, die in jedem Kern vorhanden sind. Mit anderen Worten, eine Isóbara -Spezies entsteht, wenn ein Paar Atomkerne für jede Spezies die gleiche Nettozahl von Neutronen und Protonen zeigt.
Die Anzahl der Neutronen und Protonen, die diese Nettomenge ausmachen, ist jedoch unterschiedlich. Eine Möglichkeit zu bemerken, dass es die Massenzahl (die auf der oberen linken Seite des Symbols des dargestellten chemischen Elements platziert ist) beobachten kann, da in den Isopien diese Zahl gleich ist, ist dasselbe.
Die Etymologie des Isóbaro -Term stammt aus griechischen Wörtern ISOs (was "dasselbe" bedeutet) und Baros (was "Gewicht" bedeutet), was sich auf die Gleichheit von Gewichten zwischen beiden Kernarten bezieht.
Eigenschaften der Isoparos
- Die Isoparos behalten bestimmte Ähnlichkeiten mit anderen Arten, deren Kerne Zufälle wie die isotonen aufweisen, die die gleiche Anzahl von Neutronen haben, jedoch mit unterschiedlicher Masse- und Atomzahl, wie z. B. Gleichaltrige 13C und 14NEIN 36S und 37Cl.
- Der Begriff "Nukleid" ist die Konfession, die für jede der Nuklea -Sätze (Strukturen, die durch Neutronen und Protonen gebildet werden) geprägt wurden, die gebildet werden können. So dass sich die Nukleiden möglicherweise durch ihre Anzahl von Neutronen oder Protonen oder sogar für die Menge an Energie unterscheiden, die die Struktur ihrer Konglomeration besitzt.
Kann Ihnen dienen: Verflüssigung: Konzept, Gase, Böden und seismisch, Samen- Ebenso gibt es nach dem β einen Kinderkern, und dieser Prozess wiederum ist es ein Isopar des Vaterkerns, da die Anzahl der im Kern vorhanden.
- Es ist wichtig zu bedenken, dass die verschiedenen Ióbaros eine unterschiedliche Atomzahl haben, was bestätigt.
Darstellung
Um die verschiedenen Nukreids zu bezeichnen, wird eine bestimmte Notation verwendet, die auf zwei Arten dargestellt werden kann: Man besteht darin, den Namen des chemischen Elements zu platzieren, gefolgt von ihrer Massenzahl, die durch ein Skript vereint werden. Zum Beispiel: Stickstoff-14, dessen Kern aus sieben Neutronen und sieben Protonen besteht.
Die andere Möglichkeit, diese Spezies darzustellen :
ZZUX
In diesem Ausdruck x repräsentiert es das chemische Element des fraglichen Atoms, a ist die Massenzahl (Folge der Zugabe zwischen der Menge von Neutronen und Protonen) und Z repräsentiert die Atomzahl (gleich der Menge der Protonen im Kern von das Atom).
Wenn diese Nukleiden dargestellt sind, wird die Atomzahl des Atoms (z) normalerweise weggelassen, da es keine relevanten zusätzlichen Daten gewährt, so ZUX.
Eine Möglichkeit, diese Notation zu zeigen, besteht darin, das vorherige Beispiel (Stickstoff-14) zu nehmen, das auch als als bezeichnet wird 14N. Dies ist die Notation für die Isoboos.
Kann Ihnen dienen: umfangreiche Eigenschaften der MaterieBeispiele für Isóbaros
Die Verwendung der Expression "Isóbaros" für Arten, die als Nukrids bekannt sind, die die gleiche Anzahl von Nukleonen (gleiche Massenzahl) aufweisen.
In dieser Reihenfolge der Ideen kann bei Spezies ein Beispiel für Isoboos beobachtet werden 14C und 14N: Die Massenzahl ist gleich 14, was bedeutet, dass die Anzahl der Protonen und Neutronen in beiden Arten unterschiedlich ist.
In der Tat hat dieses Kohlenstoffatom eine Atomzahl gleich 6. Dann ist Ihre Massenzahl 14 (6+8 = 14).
Das Stickstoffatom hat seinerseits eine Atomzahl von 7, so dass es aus 7 Protonen besteht, aber 7 Neutronen in seinem Kern hat. Ihre Massenzahl ist auch 14 (7+7 = 14).
Sie können auch eine Serie finden, in der alle Atome eine Massenzahl von 40 haben. Dies ist der Fall der Ióbaros: 40AC, 40K, 40Ar, 40Cl, und 40S.
Unterschiede zwischen Isoto und Isotopen
Die Nukrids beschreiben die verschiedenen Arten von Atomkern, die entsprechend der Menge an Protonen und Neutronen, die sie besitzen.
Ebenso sind zwischen diesen Arten von NuReids die Isotropos und die Isotope, die unten unterschieden werden.
Im Falle der Isóbaros haben sie, wie bereits erwähnt Defizit, also ist die Gesamtsumme gleich. Ihre Atomzahl ist jedoch anders.
Es kann Ihnen dienen: Kristalloidlösungen: Zusammensetzung, Typen und BeispieleIn diesem Sinne stammen die isopischen Spezies aus verschiedenen chemischen Elementen, sodass sie sich in verschiedenen Räumen der Periodenzüchter befinden und unterschiedliche Eigenschaften und spezifische Eigenschaften aufweisen.
Andererseits geschieht im Fall von Isotopen das Gegenteil, da sie die gleiche Atomzahl, aber eine andere Masse der Masse haben; Das heißt, sie haben die gleiche Anzahl von Protonen, aber eine andere Anzahl von Neutronen in ihren Atomkernen.
Darüber hinaus sind die Isotope atomare Arten, die zu denselben Elementen gehören, so dass sie sich im Periodenzüchttisch im selben Raum befinden und ähnliche Eigenschaften und Eigenschaften aufweisen.

