Isoleucineigenschaften, Funktionen, Biosynthese, Lebensmittel
- 664
- 72
- René Riediger
Der Isoleucin (Ile, i) ist eine der 22 Aminosäuren, die in der Natur als Teil von Proteinen vorhanden sind. Angesicht.
Diese Aminosäure wurde 1903 zum ersten Mal von Wissenschaftler F isoliert. Ehrlich aus den Stickstoffbestandteilen des Rüben- oder Rübenmelasses. Anschließend trennte derselbe Autor Isoleucin von den Zersetzungsprodukten von Fibrin und anderen Proteinen.
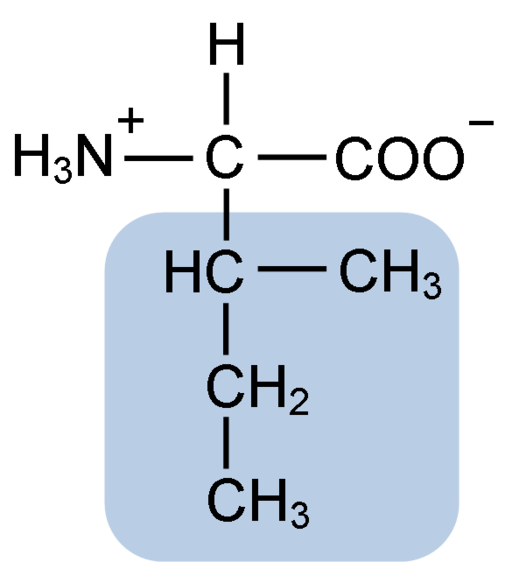
 Chemische Struktur der Isoleucin-Aminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur der Isoleucin-Aminosäure (Quelle: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Es handelt BRanchiert CHain ZUMein Nein ZUCids) Zusammen mit Leucina und Valina.
Es hat Funktionen bei der Etablierung der Tertiärstruktur vieler Proteine und beteiligt sich außerdem an der Bildung verschiedener Stoffwechselvorläufer im Zusammenhang mit dem Zellsenergiestoffwechsel.
[TOC]
Eigenschaften
Isoleucin wird innerhalb der nicht -polaren Aminosäuregruppe mit Gruppen oder Ketten asifatischer Natur klassifiziert, dh mit Kohlenwasserstoffkohlenwasserstoffketten.
Aufgrund dieser Eigenschaft bleiben die Aminosäuren dieser Gruppe wie Alanin, Valina und Leucina tendenziell nahe beieinander, was zur Stabilisierung von Proteinen beiträgt, die durch hydrophobe Wechselwirkungen teilnehmen.
Diese nicht -polare Aminosäure wiegt ungefähr 131 g/mol und ist in Proteinen in einem Verhältnis von fast 6%vorhanden, oft in der Mitte "begraben" (dank ihrer hydrophoben Qualitäten).
Struktur
Isoleucin ist eine α-Aminosäure, die wie die anderen Aminosäuren ein zentrales Kohlenstoffatom namens α (was chiral ist) aufweist, zu dem vier verschiedene Gruppen verbunden sind: ein Atom von Wasserstoff, eine Aminogruppe (-nh2), a Carboxylgruppe (-coh) und eine Seitenkette oder R-Grupo.
Die Isoleucingruppe R besteht aus einem einfachen verzweigten Kohlenwasserstoff von 4 Kohlenstoffatomen (-ch3-ch2-ch (CH3)), in dessen Kette auch ein quirales Kohlenstoffatom vorhanden ist.
Aufgrund dieser Eigenschaft hat Isoleucin vier mögliche Möglichkeiten: Zwei von ihnen sind die optischen Isomere, die als L-Isoleucin und D-Isoleucin bekannt sind, und die anderen beiden sind Diastereoisomere von L-Isoleucin. Die vorherrschende Form in Proteinen ist l-isoleucin.
Die molekulare Formel von Isoleucin ist C6H13NO2 und ihr chemischer Name ist α-Amino-β-Metyl-β-Ethylpropionic oder 2-Amino-3-methyl-Pentaton.
Funktionen
Isoleucin hat mehrere physiologische Funktionen bei Tieren, einschließlich der
- Wundheilung
- Entgiftung von Stickstoffabfällen
- Stimulation von Immunfunktionen und
- Förderung der Sekretion verschiedener Hormone.
Es wird als glykogene Aminosäure angesehen, da es als Vorläufermolekül für die Synthese von Vermittlern des Zitrussäurezyklus (Krebszyklus) dient, der anschließend zur Bildung von Glucose in der Leber beiträgt.
Aus diesem Grund wird davon ausgegangen.
Isoleucin trägt zu den Synthesewegen von Glutamin und Alanin bei und arbeitet zugunsten des Gleichgewichts zwischen verzweigten Kettenaminosäuren.
Im klinischen Bereich weisen einige Autoren darauf hin, dass ein Anstieg der Konzentrationen von Isoleucin, Leucin, Tyrosin und Valin charakteristische Marker von Tumorbewirtschaftungszellen sein kann, gefolgt von einem Anstieg der Glutaminspiegel.
Andere Funktionen
Verschiedene wissenschaftliche Forschungen haben gezeigt, dass Isoleucin für die Synthese von Hämoglobin erforderlich ist, dem Protein, das für den Transport von Sauerstoff im Blut vieler Tiere verantwortlich ist.
Darüber hinaus aktiviert diese Aminosäure den Eintritt von Nährstoffen in die Zellen. Einige Studien zeigen, dass es beim längeren Fasten Glukose als Energiequelle ersetzen kann und außerdem eine ketogene Aminosäure ist.
Es kann Ihnen dienen: Biologie TimelineKetogene Aminosäuren sind solche, deren Kohlenstoffskelette wie Fettsäuren oder Kohlenhydrate gelagert werden können, sodass sie in der Energiereserve arbeiten.
Isoleucin und andere verzweigte Kette Aminosäuren (zusätzlich zu Wachstumsfaktoren und Umweltbedingungen) arbeiten an der Aktivierung des weißen oder Zielsignals von Rapamycin, mTOR (aus dem Englischen MTananistisch TArget entwederF RApamycin).
Diese Route ist ein wichtiger Signalweg in Eukaryoten, die das Zellwachstum und den Metabolismus sowie die Proteinsynthese und Autophagieereignisse kontrollieren können. Darüber hinaus kontrolliert es den Fortschritt des Alterns und einige Pathologien wie Krebs oder Diabetes.
Biosynthese
Menschen und andere Tiere können Isoleucin nicht synthetisieren, aber dies ist ein Teil von Zellproteinen, dank ihres Erwerbs aus der Nahrung, die wir täglich konsumieren.
Pflanzen, Pilze und die meisten Mikroorganismen können diese Aminosäure aus etwas komplexen Routen synthetisieren, die normalerweise auch mit denen anderer Aminosäuren verbunden sind.
Es gibt zum Beispiel Möglichkeiten für die Herstellung von Isoleucin, Lysin, Methionin und Treonin aus dem Aspartat.
In Bakterien, insbesondere wird Isoleucin aus der Treonin-Aminosäure durch Pyruvat über einen Weg hergestellt.
Die Reaktion beginnt mit der Wirkung der Enzym-Dehydratase, die die Dehydration von Treonin katalysiert, um α-Eckobutirat und Ammonium zu produzieren (NH3). Anschließend tragen die gleichen Enzyme, die an der Biosynthese des Valins teilnehmen, zu den Schritten von bei
- Transaminierung
- Oxidative Decarboxylierung der entsprechenden Ketoaziden und
- Dehydrierung.
In dieser Art von Mikroorganismen ist die Synthese von Aminosäuren wie Lysin, Methionin, Treonin und Isoleucin sehr koordiniert und reguliert, insbesondere durch negative Rückkopplungen, wobei Reaktionen die Aktivität der beteiligten Enzyme hemmen.
Obwohl Isoleucin wie Leucin und Valin wesentliche Aminosäuren für den Menschen sind, können Aminotransferae-Enzyme, die in Körpergeweben vorhanden sind.
Degradierung
Als großer Teil der in der Natur bekannten Aminosäuren kann Isoleucin abgebaut werden, um Vermittler verschiedener Stoffwechselrouten zu bilden, unter denen der Krebszyklus (die die größte Menge an Coenzymen liefert, die für die Energieproduktion oder für die Biosynthese anderer Verbindungen arbeiten ).
Sowohl Isoleucin als auch Tryptophan, Lysin, Phenylalanin, Tyrosin, Treonin und Leucin können zur Herstellung von Acetyl-CoA verwendet werden, ein wichtiger metabolischer Intermediär für mehrere Zellreaktionen.
Im Gegensatz zu anderen Aminosäuren werden verzweigte Kettenaminosäuren (Leucin, Isoleucin und Valin) in der Leber nicht abgebaut, sondern als Kraftstoffe im Muskel, im Gehirn, in den Nieren und im Fettgewebe oxidiert.
Diese Organe und Gewebe können diese Aminosäuren dank eines Aminotransferase-Enzyms verwenden, das auf die drei wirken und ihre entsprechende Aminosäure α-ZO produzieren kann.
Sobald diese oxidierten Aminosäure-Derivate produziert wurden.
Pathologien im Zusammenhang mit dem Stoffwechsel von Isoleucin
Defekte des Stoffwechsels von Isoleucin und anderen Aminosäuren können eine Vielfalt seltsamer und komplexer Pathologien wie der Krankheit "" verursachen "Ahornsirupurin”(Urin mit ARCE -Sirup) oder verzweigte Kette Ketoacidurie.
Wie der Name schon sagt, ist diese Krankheit durch das charakteristische Aroma des Urins von Patienten gekennzeichnet, die darunter leiden, zusätzlich zu Erbrechen, Anfällen, geistiger Behinderung und vorzeitiger Tod.
Es muss sich insbesondere mit Fehlern im α-Cethoacid-Dehydrogenase-Enzymkomplex tun.
Kann Ihnen dienen: Tafonomie: Geschichte, Erhaltung und Veränderung fossilerZusammen sind Pathologien, die mit dem Katabolismus verzweigter Kettenaminosäuren wie Isoleucin zusammenhängen.
Lebensmittel, die reich an Isoleucin sind
Diese Aminosäure ist in den Muskelgeweben von Tieren reichlich vorhanden, so dass Fleisch tierischer Ursprungs wie Kuh, Schweinefleisch, Fisch und andere ähnliche wie Lamm, Hühnchen, Truthahn, Hirsche, sie sind reich an denselben.
Es ist auch in der Milchprodukte und seinen Derivaten wie Käse zu finden. Es ist in Eiern und auch in verschiedenen Arten von Samen und Nüssen als wesentlicher Bestandteil der Proteine, die sie ausmachen.
Es ist in Sojabohnen und Erbsen sowie in den Extrakten von Hefen, die mit verschiedenen Nahrungszwecken verwendet werden, reichlich vorhanden.
Die Plasmaspiegel von Isoleucin für einen erwachsenen Menschen liegen zwischen 30 und 108 μmol/l, für Kinder und Jugendliche zwischen 2 und 18 Jahren zwischen 22 und 107 μmol/l und für Säuglinge zwischen 0 und 2 Jahren zwischen 26 Jahren und 86 μmol/l.
Diese Daten legen nahe, dass der Verbrauch reicher Lebensmittel in dieser und anderen verwandten Aminosäuren für die Aufrechterhaltung vieler physiologischer Funktionen des Organismus erforderlich ist, da Menschen es nicht synthetisieren können von novo.
Vorteile Ihrer Aufnahme
Nahrungsergänzungsmittel mit Isoleucin enthalten normalerweise andere essentielle Aminosäuren der verzweigten Kette wie Valin oder Leucin oder andere.
Zu den häufigsten Beispielen für den Isoleucinverbrauch gehören die Nahrungsergänzungsmittel, die Sportler verwendet haben, um den Prozentsatz der Muskelmasse oder der Proteinsynthese zu erhöhen. Die wissenschaftliche Grundlage, auf der diese Praktiken unterstützt werden, werden jedoch ständig diskutiert, und ihre Ergebnisse sind nicht vollständig garantiert.
Isoleucin wird jedoch verwendet, um den metabolischen Wirkungen von Vitaminmangel (Pelagra) entgegenzuwirken, die für Patienten mit reichhaltigem Sorghum- und Maisdiäten charakteristisch sind, die Lebensmittel mit hohem Leucingehalt sind, die den Stoffwechsel des Tryptophans und von Nikotinsäure beim Menschen beeinflussen können.
Die Auswirkungen von Pelagra auf experimentelle Ratten beinhalten beispielsweise Wachstumsverzögerungen, die mit der Isoleucin -Supplementierung überwunden werden.
- In der Tierproduktionsindustrie
Im Bereich der Tierproduktion wurden Aminosäuren wie Lysin, Treonin, Methionin und Isoleucin in Pilottests zum Wachstum von Schweinernährung unter kontrollierten Bedingungen verwendet.
Insbesondere Isoleucin scheint Auswirkungen auf die Stickstoffassimilation zu haben, obwohl es nicht zur Gewichtszunahme dieser Nutztiere beiträgt.
- Unter klinischen Bedingungen
Einige Veröffentlichungen deuten darauf hin, dass Isoleucin in der Lage ist, den Plasma -Glukosespiegel zu senken, daher wird ihre Aufnahme bei Patienten mit Störungen wie Diabetes oder niedrigen Insulinproduktionsraten empfohlen.
Virusinfektionen
Isooleucin -Supplementierung hat sich bei Patienten, die mit Rotavirus infiziert sind, die Krankheiten wie Gastroenteritis und Durchfall bei kleinen Kindern und anderen Jungtieren verursachen, als nützlich erwiesen.
Jüngste Studien ergeben sich Muster.
Mangelerkrankungen
Mangel Isoleucin kann Probleme im Sehen, Haut, Haut (wie Dermatitis) und Darm (als Durchfall und andere gastrointestinale Manifestationen) aufweisen)).
Angesichts der Tatsache, dass es sich um eine essentielle Aminosäure für die Bildung und Synthese von Hämoglobin sowie für die Regeneration von Erythrozyten (Blutzellen) handelt Krankheiten.
Kann Ihnen dienen: tertiäre VerbraucherDies wurde experimentell in „normalen“ Nagetieren demonstriert, denen in diesem Isoleucin schlechte Diäten bereitgestellt wurden, was mit der Entwicklung wichtiger anämischer Gemälde endet.
Isoleucin beteiligt sich jedoch nur bei Säuglingen an der Bildung von Hämoglobin, da das Protein des erwachsenen Menschen keine wichtigen Mengen an solchen Aminosäuren aufweist. Dies bedeutet, dass der Mangel an Isoleucin in den ersten Entwicklungsstadien deutlicher ist.
Verweise
- Eder Plimmer, r. (1908). Die chemische Konstitution der Proteine. Ich ging weg. London, Großbritannien: Longmans, Green und Co.
- Eder Plimmer, r. (1908). Die chemische Konstitution der Proteine. Teil II. London, Großbritannien: Longmans, Green und Co.
- Barret, g., & Elmore, D. (2004). Aminosäuren und Peptide. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, K. (neunzehn sechsundneunzig). Leitfaden für den Arzt zur Labordiagnose von Stoffwechselerkrankungen (2. Aufl.).
- Bradford, h. (1931). Die Geschichte der Entdeckung der Aminosäuren. Ii. Eine Überprüfung der seit 1931 beschriebenen Aminosäuren als Komponenten nativer Proteine. Fortschritte in der Proteinchemie, 81-171.
- Campos-Ferraz, p. L., Bozza, t., Nicastro, h., & Boot, zu. H. (2013). Deutliche Auswirkungen von Leucin oder einem Gemisch der Amininosäure (Leucin, Isoleucin und Valin) für verzweigte Kette bei Resistenz gegen Müdigkeit sowie Muskel- und Leberglykogenabbau bei trainierten Ratten Ratten Ratten Ratten. Ernährung, 29(11-12), 1388-1394.
- Champe, p., & Harvey, r. (2003). Aminosäuren Aminosäuren. In Lippincotts illustrierte Bewertungen: Biochemie (3. ed., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, m. (1951). Aminosäure und Proteine in der Hämoglobinbildung 2. Isoleucin. Journal Biochemical, 49, 393-398.
- Chung, a. S., & Beames, r. M. (1974). Lysin-, Threonin-, Methionin- und Isoleucin -Supplementierung von Peace River -Gerste zum Anbau von Schweinen. Hund. J. Anim. Sci., 436, 429-436.
- Dejong, c., Meijerink, w., Van Berlo, C., Deutz, n., & Soeters, p. (neunzehn sechsundneunzig). Abstammungsplasma Isoleucin -Konzentiere nach oberem Magenerblut beim Menschen. DARM, 39, 13-17.
- Edsall, J. (1960). Aminosäuren, Proteine und Krebsbiochemie (Vol. 241). London: Academic Press, Inc.
- Britannica Encyclopaedia. (2012). Abgerufen am 30. August 2019 von https: // www.Britannica.Com/Science/Isoleucin
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Ernährungskohlenhydrat und Stoffwechsel von aufgenommenem Protein. Die Lanzette, 65-68.
- Hudson, geb. (1992). Biochemie von Lebensmittelproteinen. Springer-Science+Business Media, b.V.
- Knerr, ich., Vockley, J., & Gibson, K. M. (2014). Störungen von Leucin, Isoleucin und Valinenstoffwechsel. Gasthaus. Blau (hrsg.), Leitfaden für Arzt zur Diagnose, Behandlung und Nachuntersuchung ererbter Stoffwechselerkrankungen (pp. 103-141).
- Korman, s. H. (2006). Angeborene Fehler des Isoleucin -Abbaus: eine Überprüfung. Molekulargenetik und Stoffwechsel, 89(4), 289-299.
- Krishnaswamy, k., & Gpalan, c. (1971). Wirkung von Isoleucin auf Haut und Elektroenzephalogramm in Pellagra. Die Lanzette, 1167-1169.
- Martin, r. UND., & Kirk, k. (2007). Transport des esentialen Nährstoffs Isoleucin in menschlichen Erythrozyten, die mit dem Malaria Parasit Plasmodium Falciparum infiziert sind. Blut, 109(5), 2217-2224.
- Nationales Zentrum für Biotechnologie Information. Pubchem -Datenbank. L-Isoleucin, CID = 6306, https: // pubchem.NCBI.NLM.NIH.GOV/Compund/L-Isoleucin (zugegriffen am August. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, m. C. (2008). Wirkung von oral verabreichtem Isoleucin mit und ohne Glukose auf Insulin-, Glucagon- und Glukosekonzentrationen bei nicht-diabetischen Probanden. Das europäische E-Journal der klinischen Ernährung und des Stoffwechsels, 3(4), 152-158.
- Van Berlo, C. L. H., Van de bogaard, zu. UND. J. M., Van der heijden, m. ZU. H., Van eijk, h. M. H., Janssen, m. ZU., Bost, m. C. F., & Soeters, p. B. (1989). Ist Incredase Ammoniakbefreiung nach Blutungen im Verdauungstrakt Der Zulass des völligen Fehlens von Isoleucin im Hämoglobin? Eine Studie an Schweinen. Hepatologie, 10(3), 315-323.
- Vickery, h. B., & Schmidt, C. L. ZU. (1931). Die Geschichte der Entdeckung der Aminosäuren. Chemische Bewertungen, 9(2), 169-318.
- Wolfe, r. R. (2017). Amine für verzweigte Kette und Muskelproteinsynthese beim Menschen: Mythos oder Realität? Zeitschrift der Internationalen Gesellschaft für Sporternährung, 14(1), 1-7.
- Wu, g. (2009). Aminosäuren: Stoffwechsel, Funktionen und Ernährung. Aminosäuren, 37(1), 1-17.
- « Geschichte der Industrieökologie, Ziele, Beispiele
- Phenylalanineigenschaften, Funktionen, Biosynthese, Lebensmittel »

