Adsorptionsisothermen Konzept, Typen, Beispiele

- 3477
- 755
- Frederike Birkemeyer
Der Adsorptionsisothermen Sie sind grafische Darstellungen des Verhaltens eines adsorbierten Partikels auf der Oberfläche eines Feststoffs oder einer Flüssigkeit, wenn seine Konzentration erhöht wird. Wenn die adsorbierten Partikel denen eines Gases entsprechen, wird der Druck berücksichtigt.
Durch die Beobachtung dieser Isotherme kann eine Vorstellung davon, wie der Adsorptionsprozess stattfindet. Und daher, wie sind Partikeloberflächenwechselwirkungen und Oberflächeneigenschaften. Die Analyse der Isotherme wird abgeleitet, wenn die Oberfläche glatt, porös oder mikroporös ist, sowie mögliche Kondensationen.
 Komponenten, die für die Grafik oder Konstruktion von Adsorptionsisothermen erforderlich sind. Quelle: Gabriel Bolívar.
Komponenten, die für die Grafik oder Konstruktion von Adsorptionsisothermen erforderlich sind. Quelle: Gabriel Bolívar. Das überlegene Bild hilft, die oben genannten zu klären. Die adsorbierten Partikel (lila Kreise) sind die sogenannten Adsorbate. Während das Adsorbens derjenige ist, der einen Bereich hat, auf dem die Adsorbate adsorbiert werden. Wenn Ihr Druck oder Ihre Konzentration zunimmt, desto größer ist das adsorbierte Volumen über dem Adsorbens.
Diese einfache Darstellung entspricht einer Adsorption, die durch Typ I -Isotherme beschrieben wird. Unter Verwendung von Isothermen werden Adsorptionen von Gasen oder flüssigen Unendlichkeiten auf Gelen, Feststoffen oder Katalysatoren untersucht.
[TOC]
Arten von Adsorptionsisothermen
 Adsorptionsisothermen für gasfeste Systeme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Adsorptionsisothermen für gasfeste Systeme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Fünf der von S verwendeten wichtigsten experimentellen Isothermen sind oben gezeigt. Brunauer, um Gaspartikel auf Festkörpern zu klassifizieren. Jeder beschreibt einen anderen Adsorptionsprozess. Außerdem hat jeder mathematische Modelle, die versuchen, das Verhalten seiner Kurven abzuleiten.
Die X -Achse gibt über die Einheiten oder die in den Achsen x (p/po) und y (x) verwendeten Variablen an, wie viel Druck oder Umwandlung von Adsorbat auf dem Feststoff „wirkt“; Während die y -Achse sagt, wie viel von diesem Adsorbat wirklich auf der Oberfläche des festen oder adsorbierten Oberflächens adsorbiert wurde.
Es kann Ihnen dienen: Kupfersulfat (CUSO4): Struktur, Eigenschaften, erhalten, verwendet, verwendetWenn wir uns also rechts von der X -Achse bewegen, sehen wir, wie die Menge an adsorbierten Partikeln in Abhängigkeit von der Zunahme ihrer Drucke oder Konzentrationen zunimmt. Dies führt zu einem Maximum, einem Verfall, einem Tal usw., Das oder ein anderer erlauben es zu interpretieren, wie Adsorption stattfindet.
Typ I -Isotherme
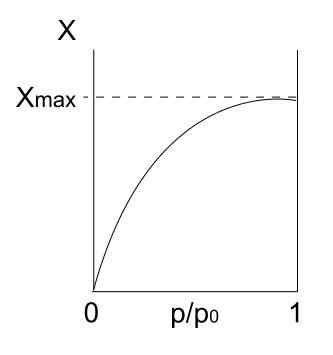 Typ I -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Typ I -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Wir haben den Typ I -Isotherme oben, der auch als Langmuir -Isotherme bekannt ist, da sein Modell die Form dieser Kurve vorhergesagt hat. Wenn man es sieht, wird sofort interpretiert, dass es eine maximale Menge (Xmax) adsorbiertes Teilchen gibt, was nicht variiert, egal wie stark der Druck zunimmt.
Dieser maximale Adsorptionswert kann aus mehreren Gründen liegen. Einer von ihnen ist, dass eine Chemisorktion stattfindet, was bedeutet, dass Partikel oder Adsorbate stark an die Oberfläche des Feststoffs oder Adsorbens gebunden sind. Sobald auf der Oberfläche keinen Platz mehr gibt, um mehr Partikel aufzunehmen, wird es keine Adsorption mehr geben.
Es wird dann gesagt, dass sich eine Monoschicht gebildet hat (wie die lila Kreise des ersten Bildes).
Ein weiterer Grund, Typ I-Isotherme zu rechtfertigen, ist, dass eine Fisisorption auftritt, was bedeutet, dass Partikeloberflächenwechselwirkungen sehr schwach sind (sie implizieren keine Bildung chemischer Bindungen).
In diesem Fall treten die Partikel in Mikroporos ein, die nach dem Füllen die Oberfläche nicht mehr Orte für die folgenden Adsorten haben. Das heißt, es hat wenig externes Gebiet (als wäre es ein sehr feines Gitter). Dieses Verhalten wird beobachtet, wenn mikroporöse Pulver analysiert werden.
Kann Ihnen dienen: Silizium: Geschichte, Eigenschaften, Struktur, Erhalten, VerwendungenGeben Sie Isotherme ein Ii
 Typ -II -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Typ -II -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Wir haben Typ -II -Isotherme, auch als Sigmoid -Isotherme bekannt. Dies beschreibt Physisprozesse sowohl für nicht -poröse Festkörper als auch für makroporöse Feststoffe.
Beachten Sie, dass es zu Beginn der vorherigen Isotherme ähnelt, was bedeutet, dass die adsorbierten Partikel auf der Adsorbensoberfläche eine Monoschicht bilden. Sobald die Monoschicht bereit ist. Dies ist, wenn wir die charakteristische Zunahme dieser Isotherme sehen (rechts).
Ein weiterer Grund, warum Typ -II -Isotherme erhalten wird. Das heißt.
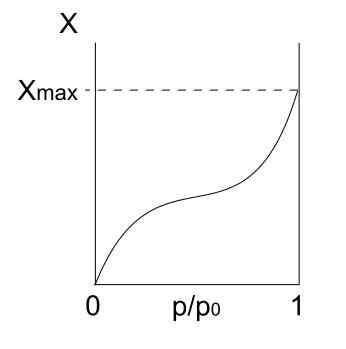
Geben Sie Isotherme ein III
 Typ III Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Typ III Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Typ -III -Isotherme ähnelt Typ II in Bezug auf seine Interpretation: Multicapas und Physis. Diesmal sind die Wechselwirkungen zwischen Multicapas jedoch stärker als die der Monoschicht mit der Oberfläche des Feststoffs. Daher handelt es sich um eine unregelmäßige Adsorption mit Hügeln von adsorbierten Partikeln und freien Oberflächenteilen.
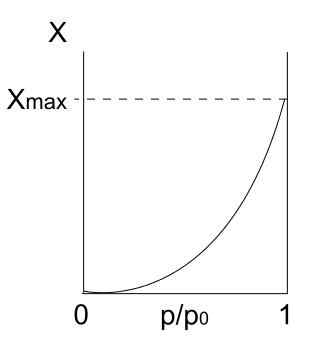
Geben Sie Isotherme ein Iv
 Typ IV -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Typ IV -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Typ IV -Isotherme beschreibt auch Fisisorptions- und Mehrschichtprozesse und sieht wie Typ -II -Isotherme aus. Aber jetzt, in porösen (und mesoporösen) Feststoffen, bei denen die Kondensation von Gaspartikeln in kleinen Flüssigkeitsvolumina möglich ist. Bis die Pore mit Flüssigkeit "bedeckt" ist, ist die Monoschicht nicht vollständig.
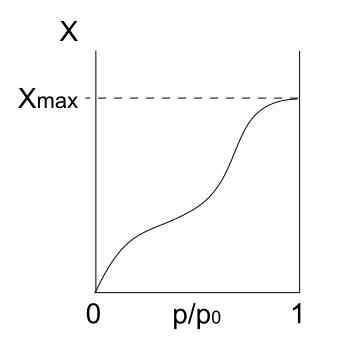
Kann Ihnen dienen: Lebensmittelchemie: Studienfeld, Elemente, AnwendungenGeben Sie Isotherme ein V
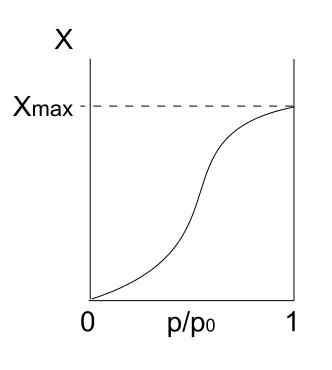 Typ V -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0)
Typ V -Isotherme. Quelle: Daniele Pugliesi/CC BY-S (https: // CreateRecommons.Org/lizenzen/by-sa/3.0) Die Typ -V -Isotherme ähnelt Typ IV, nur diesmal sind die Formationen von Multicapas anfälliger als der jeweilige Mono -FORPA. Das heißt, es ähnelt der Adsorption, die durch Typ III -Isotherme beschrieben wird. Hier erreicht Multicapa eine maximale Dicke, an der es keine Orte für mehr Partikel gibt, um zu adsorben.
Beispiele
Einige Beispiele für Gas-Solid-Systeme werden unten neben der Art der Isothermen erwähnt, die in ihren experimentellen Studien erhalten wurden:
-Ammoniak-Kohlenstoff (Typ I)
-Stickstoff-Zeolithe (Typ I)
-Wasserstoff-Kohlenstoff bei hohen Temperaturen (Typ I)
-Kohle-Sauerstoff-Negro (Typ I)
-Stickstoff aus Kieselsäure (Typ II)
-Stickstoff-hierro (Typ II)
-Kieselbromo-Gel (Typ III)
-Kieselsäure -Joddampf (Typ III)
-Stickstoffpolitisch (Typ III)
-Kripton-Negro der Kohle (Typ IV)
-Benzol-Gel aus Eisenoxid (Typ IV)
-Wasserdampf-Kohlenstoff (Typ V)
Beachten Sie, dass die genannten Feststoffe Kohle, schwarze Kohle, metallisches Eisen, Eisenoxid, Zeolithe und Kieselgel waren. Alle von ihnen sind gute Beispiele für Adsorbentien mit verschiedenen industriellen Anwendungen.
Verweise
- Walter J. Moore. (1963). Physikalische Chemie. In Thermodynamik und chemischem Gleichgewicht. (Viertes Ausgabe.). Longmans.
- Iran. Levine. (2009). Prinzipien der Physikochemie. Sechste Ausgabe, Seite 479-540. Mc Graw Hill.
- Glasstone. (1970). Lehrbuch der physikalischen Chemie. Zweite Ausgabe. D. Van Nostrand, Company, Inc.
- Einheit 3. Oberflächenphänomen. (S.F.). Adsorption. [PDF]. Erholt von: Depa.Fquim.Unam.mx
- Lowell s., Shields J.UND. (1984) Adsorptionsisothermen. In: Pulveroberfläche und Porosität. Springer, Dordrecht.
- Elsevier b.V. (2020). Adsorptionsisotherme. Scientedirect. Abgerufen von: Scientedirect.com
- Wikipedia. (2020). Adsorption. Abgerufen von: in.Wikipedia.Org

