Joseph Thomson

- 2245
- 575
- Joy Hort
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856-1940) Es war ein britischer Chemiker High. Er gewann 1906 den Nobelpreis für Physik.
Er wurde am 18. Dezember 1856 in Cheetam Hill, einem Bezirk Manchester, England, geboren. Auch als "J" bekannt.J."Thomson studierte Engineering am Owens College, derzeit Teil der University of Manchester, und dann in Mathematik in Cambridge.
Im Jahr 1890, J.J. Thomson heiratete Rose Elizabeth Paget, Tochter von Doktor Sir Edward George Paget, mit dem sie zwei Kinder hatte: ein Mädchen namens Joan Paget Thomson, und ein Kind, George Paget Thomson.
Letzterer würde ein berühmter Wissenschaftler werden, der 1937 einen Nobelpreis für Physik für ihre Arbeit mit Elektronen erhielt.
Schon in jungen Jahren konzentrierte Thomson seine Studien auf die Struktur von Atomen und entdeckte so die Existenz von Elektronen und Isotopen unter vielen anderen ihrer Beiträge.
1906 erhielt Thomson den Nobelpreis für Physik "in Anerkennung des großen Verdienstes seiner theoretischen und experimentellen Forschung zur Durchführung von Elektrizität durch Gase", wie die Jury im Urteil des oben genannten Preis.
1908 wurde er von der britischen Krone zum Ritter ernannt und diente als Ehrenprofessor für Physik in Cambridge und im Royal Institute, London.
Er starb am 30. August 1940 im Alter von 83 Jahren in der Stadt Cambridge, England. Der Physiker wurde in Westminster Abbey in der Nähe von Sir Isaac Newtons Grab beigesetzt.
Beiträge von Joseph Thomson zu Wissenschaft und Chemie
Elektronenentdeckung
Im Jahr 1897, j.J. Thomson entdeckte ein neues Lichtteilchen als Wasserstoff, das "Elektron" getauft wurde.
Es kann Ihnen dienen: Bestimmung der Asche: Methoden und BeispieleWasserstoff wurde als Atomgewichtsmesseinheit angesehen. Bis zu diesem Zeitpunkt war das Atom die kleinste Aufteilung der Materie.
In diesem Sinne war Thomson der erste, der die negativ beladenen korpuskulären subatomaren Partikel entdeckte.
Thomson Atomic Model
Thomsons Atommodell war die Struktur, die der englische Physiker Atomen zuschreibt. Für den Wissenschaftler waren Atome eine positive Ladungskugel.
In dieser positiven Lastwolke waren negativ verteilte Elektronen gleichmäßig eingebettet, dh die positive Belastung des Atomteigs neutralisiert.
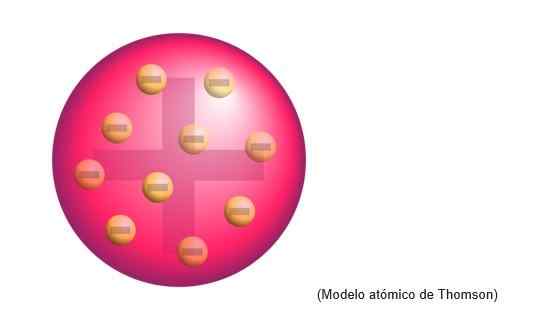
Dieses neue Modell ersetzt die von Dalton ausgearbeitete und wird später von Rutherford, Thomsons Schüler in den Cavendish Laboratories von Cambridge, widerlegt.
Trennung von Atomen
Thomson verwendete positive oder anodische Strahlen, um Atome von unterschiedlicher Masse zu trennen. Diese Methode ermöglichte es ihm, den von jedem Atom transportierten Strom und die Anzahl der Moleküle pro Kubikzentimeter zu berechnen.
Der Physiker in der Lage war, die Atome unterschiedlicher Masse und Last zu teilen, entdeckte die Existenz von Isotopen. Auf diese Weise führte er mit seiner Untersuchung positiver Strahlen einen großen Fortschritt in Richtung Massenspektrometrie.
Entdeckung von Isotopen
J.J. Thomson entdeckte, dass Neonionen unterschiedliche Massen hatten, dh unterschiedliches Atomgewicht. So zeigte Thomson, dass das Neon zwei Subtypen von Isotopen hat, das Neon-20 und das Neon-22.
Die bis heute untersuchten Isotope sind Atome desselben Elements, aber ihre Kerne haben eine andere Massenzahl, da sie aus verschiedenen Mengen von Neutronen in ihrem Zentrum bestehen.
Experimente mit Kathodenstrahlen
Kathodenstrahlen sind Elektronenströme in Vakuumröhrchen, dh Glasrohre mit zwei Elektroden, ein positives und ein Negativ.
Kann Ihnen dienen: Chromhydroxid: Struktur, Eigenschaften, Synthese, verwendetWenn die negative Elektrode erhitzt wird, auch als Kathode bezeichnet wird, emittiert sie Strahlung, die auf die positive Elektrode oder Anode gerichtet ist, in einer geraden Linie, wenn in dieser Route kein Magnetfeld auftritt.
Wenn die Glaswände des Rohrs mit fluoreszierendem Material bedeckt sind, erzeugt der Putsch der Kathoden gegen diese Schicht die Projektion von Licht.
Thomson untersuchte das Verhalten von Kathodenstrahlen und kam zu den Schlussfolgerungen, dass sich die Strahlen gerade ausbreiten.
Er kam auch zu dem Schluss, dass diese Strahlen durch das Vorhandensein eines Magneten, dh eines Magnetfeldes. Darüber hinaus konnten die Strahlen die Klingen mit der Stärke der Elektronen zirkulieren, was zeigt, dass die Elektronen Masse hatten.
J.J. Thomson erlebte das Gas im Kathodenstrahlrohr, aber das Verhalten von Elektronen variierte nicht. Ebenso erwärmten die Kathodenstrahlen die Objekte, die auf der Straße zwischen den Elektroden interpitiert wurden.
Zusammenfassend hatte Thomson gezeigt, dass Kathodenstrahlen leichte, mechanische, chemische und thermische Wirkungen hatten.
Die Kathodenstrahlröhren und ihre leichten Eigenschaften waren transzendental für die anschließende Erfindung von Tube Television (CTR) und Videokameras.
Massenspektrometer
J.J. Thomson schuf einen ersten Ansatz zu Massenspektrometer. Dieses Tool ermöglichte dem Wissenschaftlerstudium.
Mit dieser Untersuchung kam er zu dem Schluss, dass die Kathodenstrahlen aus negativen Lastkorpuskeln bestanden, die sich innerhalb der Atome befinden, wodurch die Spaltbarkeit des Atom.
Es kann Ihnen dienen: Buttersäure: Formel, Eigenschaften, Risiken und VerwendungAußerdem wurden die Fortschritte in der Massenspektrometrie bis heute fortgesetzt und sich in verschiedenen Methoden entwickelt, um die Elektronen von Atomen zu trennen.
Außerdem war Thomson der erste, der vorschlug, der vorschlug Die erste Wellenführung 1893. Dieses Experiment bestand aus Spread.
Wellenführer würden in Zukunft bis heute mit Datenübertragung und optischen Fasern weit verbreitet sein.
Thomsons Erbe
Der Thomson (TH) wurde als Massenbelastungseinheit in der Massenspektrometrie eingerichtet, die von Köchen und Rockwood-Chemikalien zu Ehren von Thomson vorgeschlagen wurde.
Diese Technik ermöglicht es, die Verteilung der Substanzmoleküle entsprechend ihrer Masse zu bestimmen und, wie dies in einer Stichprobe vorhanden ist.
Thomson -Formel (TH):
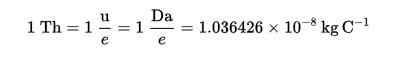
Hervorragende Werke
- Das Entspannen von Elektrizität durch Gase, Strom durch Gase (1900).
- Die korpuskuläre Materie, das Elektron in Chemie und Erinnerungen und Reflexionen (1907).
- Jenseits des Elektrons (1928).
Verweise
- Nobel Media AB (2014). J. Thomson - Biografisch. Nobelpreis.Org. Nobelpreis.Org.
- Thomson, Joseph J., Elektrizität durch Gasenverhalten. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Der diskrete Charme von Elementarpartikeln.
- Christen, Hans Rudolf, Grundlagen der allgemeinen und anorganischen Chemie, Band 1. Barcelona, Spanien. Editionen kehrt um.ZU., 1986.
- Arzani, Aurora Cortina, Elementary General Chemistry. Mexiko, Porrúa Editorial, 1967.
- R. G. Köche, a. L. Rockwood. Schnelle Kommunikation. Massenspektrom. 5, 93 (1991).

