Lacasas -Eigenschaften, Struktur, Funktionen
- 1085
- 23
- Joe Hartwig
Der die Häuser, P-Dipenol: oxidorte Dioxygen oder Benzediol-Sauerstoffoxiduktase.
Es gibt in den oberen Pflanzen, in einigen Insekten, in Bakterien und in praktisch allen untersuchten Pilzen; Seine charakteristische blaue Farbe ist ein Produkt von vier Kupferatomen, die an dem Molekül in seiner katalytischen Stelle angebracht sind.
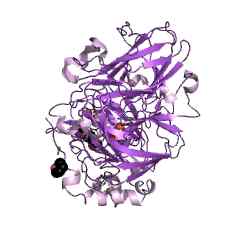
 Grafische Darstellung der molekularen Struktur eines Enzym -Lacasa (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons)
Grafische Darstellung der molekularen Struktur eines Enzym -Lacasa (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter am Europäischen Bioinformatikinstitut [Public Domain] über Wikimedia Commons) Diese Enzyme wurden von Yoshida und Mitarbeitern im Jahr 1883 beim Studium des Baumharzes beschrieben Rhus Vernicifera oder "Lackbaum" Japaner, wo festgestellt wurde, dass seine Hauptfunktion darin bestand.
Viel später wurde festgestellt, dass diese Proteine mit enzymatischer Aktivität in Pilzen spezifische Funktionen bei den Mechanismen der Entfernung von toxischen Phenolen aus dem Medium haben, in dem sie wachsen, während sie in Pflanzen an synthetischen Prozessen wie der Abzweigung beteiligt sind.
Die wissenschaftlichen Fortschritte in Bezug auf die Untersuchung dieser Enzyme ermöglichten ihre Beschäftigung auf industrieller Ebene, in der ihre katalytische Kapazität, insbesondere in den Kontexten der Bioremediation, Textilerie, bei der Entfernung von Farbstoffen, die auf Textilien in der Papierbranche, zwischen anderen angewendet wurden, eingesetzt wurden.
Die Hauptgründe, warum Lacasas aus industrieller Sicht so interessant sind.
[TOC]
Eigenschaften
Lacasas -Enzyme können sekretiert werden oder sich in der intrazellulären Region befinden, aber dies hängt von dem Körper ab, der untersucht wird. Trotzdem sind die meisten analysierten Enzyme (mit Ausnahme einiger Proteine bestimmter Pilze und Insekten) extrazelluläre Proteine.
Kann Ihnen dienen: ProtobiontenVerteilung
Diese Enzyme sind, wie oben erwähnt, überwiegend in Pilzen, in oberen Pflanzen, in Bakterien und in einigen Insektenarten.
Unter den Pflanzen, in denen ihre Existenz nachgewiesen wurde. Insekten, die Lacasas exprimieren, gehören hauptsächlich zu Genres Bombyx, Calliphora, Diploptera, Drosophila, Musca, Papilio, Rhodnius, und andere.
Pilze sind die Organismen, deren Lack und Vielfalt von Lacasas isoliert und untersucht wurden, und diese Enzyme sind sowohl in Ascomycetes als auch in Deuteromice und Basidiomyceten vorhanden.
Katalyse
Die Reaktion, die Lakasen katalyziert.
Das Ergebnis der katalytischen Reaktion ist die Reduktion eines Sauerstoffmoleküls auf zwei Wassermoleküle und Oxidation gleichzeitig von vier Substratmolekülen, um vier freie reaktive Radikale zu erzeugen.
Vermittlungsradikale können Dímeros, Oligomere oder Polymere binden und bilden. Daher wird gesagt, dass Lacasas Polymerisationsreaktionen und "Depolimerisierung" katalysieren, dass Lacasas -Polymerisationsreaktionen katalysiert werden.
Struktur
Lacasas sind Glykoproteine, dh Proteine mit Oligosacchariden, die kovalent mit der Polypeptidkette vereint sind, und diese repräsentieren zwischen 10 und 50% des Gesamtgewichts des Moleküls (auf den Gemüseenzymen kann der Prozentsatz etwas höher sein).
Der Kohlenhydratanteil dieser Proteintyp enthält Monosaccharide wie Glucose, Galactose, Fucosa, Araber und einige Hexosamine, und es wird angenommen.
Im Allgemeinen werden diese Enzyme in der Natur als Monomere oder Homodimiker gefunden, und das Molekulargewicht jedes Monomers kann zwischen 60 und 100 kDa variieren.
Das katalytische Zentrum von Lacasas besteht aus vier Kupferatomen (CU), die dem Molekül im Allgemeinen eine blaue Farbe gewähren.
Kann Ihnen dienen: AllometrieGemüselakasen haben isoelektrische Punkte mit Werten nahe 9 (ganz grundlegend), während Pilzenzyme zwischen isoelektrischen Punkten von 3 und 7 liegen (so sind sie Enzyme, die unter sauren Bedingungen funktionieren).
Isoenzyme
Viele Pilze, die Lakasen produzieren. Diese Isoenzyme unterscheiden.
Unter bestimmten Bedingungen können diese Isoenzyme unterschiedliche physiologische Funktionen haben, dies hängt jedoch von der Art oder dem Zustand ab, in dem sie in Bevölkerung kommt.
Funktionen
Einige Forscher haben gezeigt, dass Lacasas an der "Sklerotisierung" der Nagelhaut in Insekten und an der Anordnung von Sporen gegen Ultraviolettlicht in Mikroorganismen des Genres beteiligt ist Bazillus.
In Pflanzen
In Pflanzenorganismen beteiligen sich Lacasas an der Bildung der Zellwand, an den Prozessen der Lignifikation und des "Nachteils" (Verlust oder Zerfall von Lignin); Darüber hinaus wurden sie mit der Entgiftung der Gewebe durch oxidierte Antimykotika -Phenole oder der Deaktivierung von Phytoexinen verwandt.
In Pilzen
In dieser Gruppe von Organismen sind Lacasas an einer Vielzahl von Zell- und physiologischen Prozessen teilnehmend vorhanden. Unter ihnen kann der Schutz der pathogenen Pilze der Tannine und des pflanzlichen "Phytoexine" erwähnt werden; Es kann also gesagt werden, dass diese Enzyme für Pilze Virulenzfaktoren sind.
Lacasas haben auch Funktionen in der Morphogenese und Differenzierung von Resistenzstrukturen und Sporen von Basidiomyceten sowie zum biologischen Abbau von Lignin in Pilzen, die Gewebe von Holzarten abbauen.
Es kann Ihnen dienen: Unterschiede zwischen Wissenschaft und TechnologieGleichzeitig beteiligen sich Lakasen an der Bildung von Pigmenten des Myzels des Immunsystems von Wirten, die mit pathogenen Pilzen infiziert sind.
In der Industrie
Diese besonderen Enzyme werden industriell mit mehreren Zwecken eingesetzt, aber die herausragendsten entsprechen den Textil- und Grenzindustrien sowie den Prozessen der Bioremediation und Dekontamination von Abwasserprodukten anderer industrieller Prozesse.
Pünktlich werden diese Enzyme häufig zur Oxidation von Phenolen und ihren Derivaten verwendet.
In der Lebensmittelindustrie haben sie auch eine gewisse Bedeutung, da die Entfernung von Phenolverbindungen für die Stabilisierung von Getränken wie Wein, Bier und natürliche Säfte erforderlich ist.
Sie werden in der Kosmetikindustrie, in der chemischen Synthese vieler Verbindungen, in der Bioremediation von Böden und in der Nanobiotechnologie verwendet.
Am häufigsten sind Lacasas aus Pilzen, aber in letzter Zeit wurde jedoch festgestellt, dass Bakterien -Lacasas aus ausstehenderen Merkmalen aus industrieller Sicht mehr Merkmale aufweisen. Sie sind in der Lage, mit der größten Vielfalt von Substraten und mit viel breiteren Temperatur- und pH -Bereichen zusammenzuarbeiten, und sind auch vor den Hemmungsmitteln viel stabiler.
Verweise
- Claus, h. (2004). Laccasen: Struktur, Reaktion, Verteilung. Mikron, 35, 93-96.
- Couto, s. R., Luis, J., & Herrera, t. (2006). Industrielle und biotechnologische Anwendungen von Laccasen: eine Überprüfung. Biotechnologie Fortschritte, 24, 500-513.
- Madhavi, v., & Lele, s. S. (2009). Laccase: Eigenschaften und Anwendungen. Bioresoources, 4(4), 1694-1717.
- Riva, s., Molecolare, r., & Bianco, v. M. (2006). Laccasen: Blaue Enzyme für die grüne Chemie. Trends in der Biotechnologie, 24(5), 219-226.
- Singh, p., Bindi, c., & Arunika, G. (2017). Bakterienlaccase: Aktuelle Aktualisierung von Produktion, Eigenschaften und industriellen Anwendungen. Biotech, 7(323), 1-20.
- « Was sind Coplanares -Vektoren? (Mit gelösten Übungen)
- Katalaseeigenschaften, Struktur, Funktionen, Pathologien »

