Laminina -Eigenschaften, Struktur, Funktionen, Typen
- 3367
- 416
- Lewis Holzner
Der Laminin Es ist eines der Proteine, die die extrazelluläre Matrix der Basalmembran von Epithelgeweben bei Wirbeltieren ausmachen. Diese Art von Protein liefert eine Bindungsunterstützung zwischen konjunktiven Gewebezellen, so dass sie in der Zusammenhalt und Verdichtung dieser arbeiten.
Im Allgemeinen sind Laminine für die Bestellung des komplizierten Proteinnetzes verantwortlich, das die extrazelluläre Matrix oder die Basalgewebemembran bildet. Typischerweise sind Laminine mit Proteinen wie Kollagen, Proteoglykanen, Entactinen und Hepar assoziiert Sulfat.
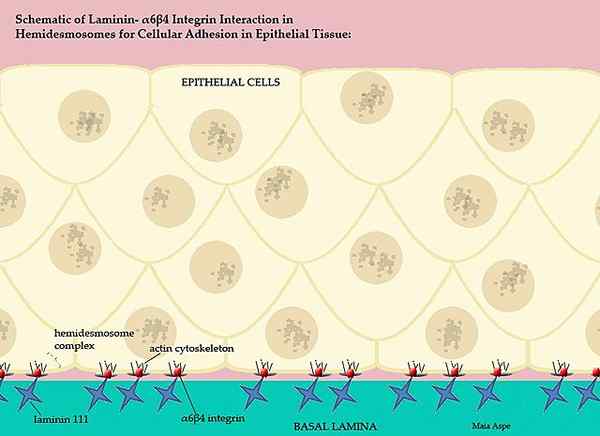
 Laminine und ihre Teilnahme an der Basal-Wirbeltiermembran (Quelle: Maiaaspe/CC BY-S (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Laminine und ihre Teilnahme an der Basal-Wirbeltiermembran (Quelle: Maiaaspe/CC BY-S (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Diese komplizierte Basalmembran, die von den Lamininen geordnet ist, trennt die epithelialen Teile des Gewebe.
Viele Untersuchungen haben gezeigt, dass die Expression mutierter Laminine -Gene für eine Zelle möglicherweise tödlich ist.
Es gibt eine große Vielfalt von Laminins -Familien in allen Wirbeltieren. Diese variieren in Zusammensetzung, Form, Funktion und Herkunft. In derselben Person können in verschiedenen Geweben unterschiedliche Laminine gefunden werden, die jeweils an die Umgebung des Gewebes angepasst werden, die es ausdrückt.
[TOC]
Laminina -Eigenschaften
Lamininmonomere oder Einheiten bestehen aus einem anderen Heterotromer mit Glykoproteinketten. Diese Proteine enthalten viele verschiedene Domänen (Multidominium) und sind ein wesentlicher Bestandteil der frühen embryonalen Entwicklung von Geweben.
Die gemeinsame Form von Lamininen ist eine Art "Kreuz" oder "Y", obwohl einige eine lange Balkenform mit vier Auswirkungen haben. Diese kleine Variation ermöglicht jede Art von Laminin regelmäßig die angemessene Integration aus einer beliebigen Position im Gewebe.
Es kann Ihnen dienen: p-nitrofenol: Eigenschaften, Verwendung und ToxizitätLaminine haben ein hohes Molekulargewicht, was je nach Art von Laminin von 140 bis 1000 kDa variieren kann.
Im Allgemeinen hat jede Basalmembran eine oder mehrere verschiedene Arten von Lamininen im Inneren und einige Wissenschaftler schlagen vor, dass Laminine einen großen Teil der physiologischen Funktion der Basalmembranen des Gewebes bestimmen, in dem sie gefunden werden.
Bei Tieren von Wirbeltieren wurden mindestens 15 verschiedene Arten von Lamininen gefunden, die in einer Familie klassifiziert sind, da sie aus demselben Trimmer gebildet werden, jedoch mit unterschiedlichen Kombinationen. Bei Wirbellosen haben sie zwischen 1 und 2 verschiedenen Trimeren gefunden.
Aktuelle Studien legen nahe, dass Laminine aller Wirbeltiere durch die Differenzierung von Orthologen entstanden sind, dh alle Gene, die für Laminine kodieren.
Struktur
Trotz der großen Anzahl von Funktionen, die Laminine regulieren, haben sie eine ziemlich einfache Struktur, die größtenteils unter den verschiedenen bekannten Typen erhalten bleibt.
Jedes Laminin besteht aus drei verschiedenen Ketten, die miteinander verflochten sind und eine Art "miteinander verwobene Faser" bilden. Jede der drei Ketten wird als ALFA (α), Beta (β) und Gamma (γ) identifiziert.
Die Bildung des Trimers jedes Laminins hängt von der Vereinigung der C-terminalen Region jeder seiner Ketten ab. In jedem Molekül werden diese Ketten durch Peptidverbindungen und drei Disulfidbrücken gepaart, die der Struktur einen großen mechanischen Widerstand verleihen.
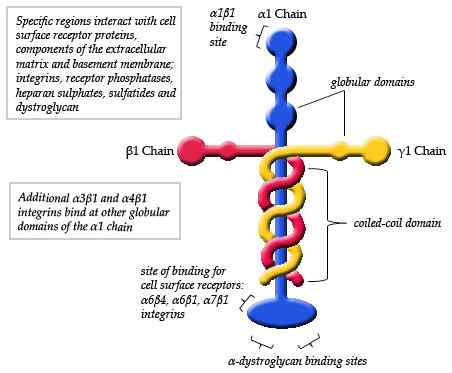 Schematisches Diagramm der Struktur eines Laminins (Quelle: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons)
Schematisches Diagramm der Struktur eines Laminins (Quelle: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/lizenzen/by-sa/3.0) über Wikimedia Commons) Die Beobachtungen, die durch elektronische Mikroskopie der typischen Lamininmonomere durchgeführt werden.
Kann Ihnen dienen: BevölkerungsdynamikZusätzlich werden drei kurze Arme beobachtet, zwei von ungefähr 34 nm und einer von ungefähr 48 nm. Jeder Arm endet an einem kugelförmigen Ende, ähnlich der Hauptkette, aber kleinerer Größe.
Der Unterschied zwischen den verschiedenen Arten von Lamininen ist hauptsächlich auf Unterschiede in α -Ketten zurückzuführen, die auf mindestens drei verschiedene Arten gefaltet werden können. Obwohl derzeit Variationen für alle Ketten identifiziert wurden:
- 5 verschiedene Variationen oder Ketten von Laminin α
- 3 Variationen von β -Ketten
- 3 Variationen für γ -Ketten
Funktionen
Die wichtigste und am häufigsten untersuchte Funktion von Lamininen ist die Wechselwirkung mit den Rezeptoren, die in den Zellmembranen der Zellen neben den Basalmembranen verankert sind, in denen diese gefunden werden.
Diese Wechselwirkung lässt diese Proteine an der Regulation mehrerer zellulärer Aktivitäten und Signalwege beteiligt sein. Es liegt an der Erwähnung, dass ihre Funktionen von ihrer Wechselwirkung mit bestimmten Rezeptoren auf der Zelloberfläche abhängen (viele der Membranrezeptoren werden derzeit nach ihrer Fähigkeit eingestuft, mit Lamininen zu arbeiten).
Integrine sind die Rezeptoren, die mit den "Nicht -Integrin" -Lamininen interagieren, und Rezeptoren sind diejenigen, die nicht die Fähigkeit haben, diesen Proteinen beizutreten. Die meisten der „nicht integrierten“ Rezeptoren sind Proteoglykane, einige Dystroglykane oder Sydecanos.
Die Reifung der Gewebe der Körperorgane findet mit einem Ersatz von frühen Lamininen statt, die ursprünglich in der Basalmembran der Gewebe untergebracht waren, die die Jugendorgane bildeten.
Innerhalb der Laminine ist der am meisten untersuchte Typ Laminin-1, der direkt mit dem Wachstum von Axonen praktisch jeder Art von Neuron unter Bedingungen verbunden ist In vitro, da sie die Bewegung des "Wachstumskegels" auf der Oberfläche der Neuronen regulieren.
Kann Ihnen dienen: Harnstoffbrühe: Was ist, Foundation, Vorbereitung, verwendetNomenklatur und Typen
Biochemisten betrachten die Familie von Lamininen als eine sehr große Proteinfamilie, von der nur wenige ihrer Mitglieder noch bekannt sind. Moderne Werkzeuge ermöglichen es jedoch, neue Arten von Lamininen zu erkennen.
Solche Proteine werden jeweils mit einer Zahl identifiziert, beginnend mit 1, die die Nummerierung in 15 beenden (Laminin-1, Laminin-2 ... Laminina-15).
Eine andere Art von Nomenklatur wird ebenfalls verwendet, was angibt, in welcher Art der Kette, die jedes Laminin hat. Zum Beispiel besteht Laminin -11 aus einer ALFA (α) -5 -Kette, durch eine Beta -Kette (β) -2 und durch eine Gamma -Kette (γ) -1, sodass es Laminina -521 genannt werden kann.
Darüber hinaus wird jedes Laminin gemäß der Funktion klassifiziert, die damit verbunden ist, dass es assoziiert ist, und auch nach dem spezifischen Körpergewebe, an dem es teilnimmt. Einige Beispiele für Laminine sind:
- Lamina-1: die an der epithelialen Entwicklung beteiligt ist
- Laminina-2: Beteiligt an der myogenen Entwicklung aller Gewebe, des peripheren Nervensystems und der Glomerulusmatrix.
- Lamina-3: Nehmen Sie an My-Tendinous-Gewerkschaften teil
- Lamina-4: Arbeiten in neuromuskulären Gewerkschaften und in der Mesangialmatrix von Glomeruli
- Laminina-5, 6 und 7: Sie wirken vorzugsweise in epidermalen Geweben.
Verweise
- Bergmann, J. H., & Yurchco, p. D. (2004). Lamininfunktionen in der Gewebemorphogenese. Annu. Rev. Cell Dev. Biol., 20, 255-284.
- Rasmussen, d. G. K., & Karsdal, m. ZU. (2016). Laminine. In Biochemie von Kollagenen, Lamininen und Elastin (PP. 163-196). Akademische Presse.
- Sasaki, t., Fässler, r., & Hohenester und. (2004). Laminin: Der Kern der Basalmembranbaugruppe. The Journal of Cell Biology, 164 (7), 959-9633.
- Timpl, r., Engel, j., & Martin, G. R. (1983). Multifunktionales Laminin-A-Protein von Basalmembranen. Trends in biochemischen Wissenschaften, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, p. G., Rennard, s. Yo., Foidart, j. M., & Martin, G. R. (1979). Laminin-a-Glykoprotein aus Kellermembranen. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Die Familie Laminin. Aktuelle Meinung in der Zellbiologie, 5 (5), 877-882.

