LDH -Funktionen, Bestimmung, Reaktion, Normalwerte
- 4126
- 36
- Luca Holdt
Der Laktat -Dehydrogenase, Milchsäurehydrogenase, Laktat-NAD-abhängiger Abhängigkeit oder einfach LDH, ist ein Enzym, das zur Oxidorticas-Gruppe gehört, die praktisch in allen tierischen Geweben, Gemüse und in vielen Mikroorganismen wie Bakterien, Hefen und Bögen vorkommt.
Enzyme dieser Art werden mit der Zahl EC 1 bezeichnet.1.1.27 des enzymatischen Nomenklaturkomitees und sind für die Reaktion verantwortlich, die Laktat in Pyruvat (durch Oxidation) umwandelt und umgekehrt (durch Reduktion), oxidiert oder reduziert Dyukleotide der Adeninnikotinamid (NAD+ und NADH) in dem als als laktischen Fermentation bekannten Prozess, der als laktische Fermentation der Fermentation bekannt ist, um.
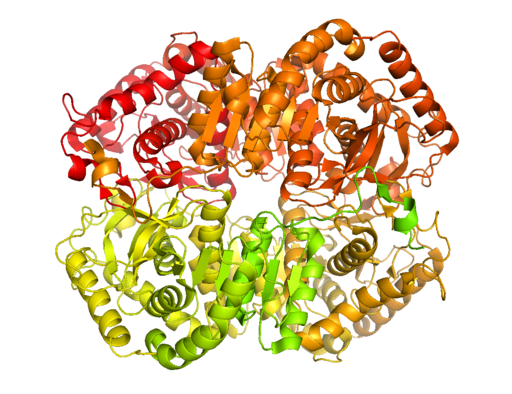
 Kristalline Struktur der Lactat-Dehydrogenase B (Quelle: BCDOYE [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons)
Kristalline Struktur der Lactat-Dehydrogenase B (Quelle: BCDOYE [CC BY-SA 3.0 (https: // creativecommons.Org/lizenzen/by-sa/3.0)] über Wikimedia Commons) Im Gegensatz zur alkoholischen Fermentation, die nur in einigen Mikroorganismen wie Hefen und Verwendung auftritt.
Dieses wichtige Enzym für den Zellstoffwechsel wurde in den 1940er Jahren aus dem Skelettrattenmuskel kristallisiert und bisher die am besten charakterisierten Skelettmuskeln und das Herzgewebe bei Säugetieren.
Bei „überlegenen“ Tieren verwendet das Enzym das Lactat-L-Isomer (L-Lactat) zur Herstellung von Pyruvat, aber einige „niedrigere“ Tiere und Bakterien produzieren D-Lactat aus dem durch Glykolyse erhaltenen Pyruvat.
Laktatdehydrogenase wird normalerweise hauptsächlich in Geweben oder Zellen unter anaeroben Bedingungen (niedrige Blutbewässerung) exprimiert, die beispielsweise beim Menschen pathologische Erkrankungen wie Krebs, Leber oder Herzbedingungen charakterisieren können.
Die Umwandlung des Pyruvats in Laktat ist jedoch typisch für die Muskeln während der Übung und die Hornhaut des Auges, die schlecht sauerstoffhaltig ist.
[TOC]
Funktionen
Lactatdehydrogenase erfüllt mehrere Funktionen auf zahlreichen Stoffwechselwegen. Es ist das Zentrum des empfindlichen Gleichgewichts zwischen den katabolen und den anabolischen Routen der Kohlenhydrate.
Während der aeroben Glykolyse Pyruvat (das letzte Produkt der Route an sich) Es kann als Substrat der enzymatischen Komplexpyruvat-Dehydrogenase verwendet werden, durch die es decarboxyliert ist und Acetyl-CoA.
In der anaeroben Glykolyse produziert im Gegenteil der letzte Schritt der Glykolyse Pyruvat, dies wird jedoch durch Laktat -Dehydrogenase zur Herstellung von Laktat und NAD verwendet+, Das stellt die NAD wieder her+ die während der Reaktion verwendet wurde, die durch Glyceraldehyd 3-phosphat-Dehydrogenase katalysiert wurde.
Wie während der Anaerobiose ist die Hauptquelle für die Energieerzeugung in Form von ATP die Glykolyse. Lactatdehydrogenase spielt eine grundlegende Rolle bei der Reoxidation der NADH, die in früheren Schritten der glykolytischen Route produziert wurde, wesentlich für den Betrieb anderer verwandter Enzyme wesentlich.
Kann Ihnen dienen: TubulinLactatdehydrogenase ist auch an der Glykogenese beteiligt, die in Geweben stattfindet, die Lactat in Glykogen umwandeln, und in einigen aeroben Geweben wie dem Herzen ist Laktat ein Brennstoff, der wieder oxen ist, um Energie zu produzieren und die Leistung in Form von ATP und NAD zu reduzieren+, bzw.
Eigenschaften und Struktur
Es gibt mehrere molekulare Formen von Laktat -Dehydrogenase in der Natur. Nur bei Tieren wurde festgestellt, dass es fünf Aktivitäten gibt Lactat-Dehydrogenase, alle tetrameren und im Wesentlichen aus zwei Arten von Polypeptidketten, die als Untereinheiten H und M bekannt sind (in der Lage sind, homo- oder heterotramérica) zu sein).
Die H -Form ist typischerweise im Herzstoff, während die M -Form im Skelettmuskel nachgewiesen wurde. Beide Ketten unterscheiden sich in Bezug auf Häufigkeit, Aminosäurezusammensetzung, kinetische Eigenschaften und strukturelle Eigenschaften.
H- und M -Formen sind das translationale Produkt verschiedener Gene, möglicherweise in verschiedenen Chromosomen, und die auch unter der Kontrolle oder Regulation verschiedener Gene stehen. Die H -Form ist in Geweben mit dem aeroben Metabolismus und der M -Form in anaeroben Geweben vorherrschend.
Eine andere Art von Nomenklatur verwendet Buchstaben A, B und C für die verschiedenen Arten von Enzymen bei Säugetieren und Vögeln. Somit ist die Dehydrogenase des Laktatmuskels als bekannt als4, Herz als b4 und ein dritter heißt c4, das ist spezifisch für die Hoden.
Die Expression dieser Isoenzyme wird sowohl in einer Form von Entwicklungsabhängiger als auch in Gewebeabhängigkeit reguliert.
Das Enzym wurde aus verschiedenen tierischen Quellen isoliert und es wurde festgestellt+ Es besteht aus einem β-Peeled-Blatt, das aus sechs Ketten und 4 Alpha-Propellern besteht.
Festlegung
Durch Spektrophotometrie
Die Dehydrogenase der Laktataktivität tierischer Herkunft ist bestimmt spektrophotometrisch In vitro Durch Messungen der Färbung Änderungsmessungen dank des Oxidorreduktionsprozesses, der während der Reaktion der Laktatpyruvatkonvertierung stattfindet.
Die Messungen werden bei 340 nm mit einem Spektrophotometer durchgeführt und die Abnahme der optischen Dichte aufgrund von Oxidation oder „Verschwinden“ von NADH wird bestimmt, was in NAD umgewandelt wird+.
Das heißt, die bestimmte Reaktion lautet wie folgt:
Pyruvat + Nadh + h+ → Laktat + nad+
Die enzymatische Messung sollte unter optimalen pH -Bedingungen und der Konzentration von Substraten für das Enzym durchgeführt werden.
Durch Immunhistochemie
Eine andere Methode, vielleicht etwas moderner, für die Bestimmung des Vorhandenseins von Laktatdehydrogenase hat mit der Verwendung immunologischer Werkzeuge zu tun, dh unter Verwendung von Antikörpern.
Kann Ihnen dienen: Homologie (Biologie)Diese Methoden nutzen die Affinität zwischen der Vereinigung eines Antigens mit einem spezifisch dagegen erzeugten Antikörper und sind sehr nützlich für die schnelle Bestimmung des Vorhandenseins oder des Fehlens von Enzymen wie LDH in einem bestimmten Gewebe.
Abhängig vom Zweck müssen die verwendeten Antikörper spezifisch für den Nachweis eines der Isoenzyme oder für Protein mit Laktataktivitätsdehydrogenase sein.
Warum Dehydrogenase -Laktat bestimmen?
Die Bestimmung dieses Enzyms erfolgt mit unterschiedlichen Zwecken, jedoch hauptsächlich für die klinische Diagnose einiger Erkrankungen, einschließlich Myokardinfarkt und Krebs.
Auf zellulärer Ebene wurde die Freisetzung von Dehydrogenase -Lactat als einer der Parameter zur Bestimmung des Auftretens nekrotischer oder apoptotischer Prozesse angesehen, da die Plasmamembran durchlässig wird.
Die Produkte der Reaktion, die Catalyz auch in einem Gewebe bestimmt werden kann, um festzustellen, ob ein anaeroben Metabolismus aus irgendeinem besonderen Grund vorherrscht.
Reaktion
Wie zunächst bemerkte, ist das Enzym -Lactat -Dehydrogenase, dessen systematischer Name ist (S) -Lactato: nad+ Dehydrogenase, Katalyz -Lactatumwandlung in ein Pyruvat+ abhängig oder umgekehrt, was dank der Übertragung eines Hydridions (H) auftritt-) Vom Pyruvat bis zum Laktat oder von Nadh bis zum oxidierten Pyruvat.
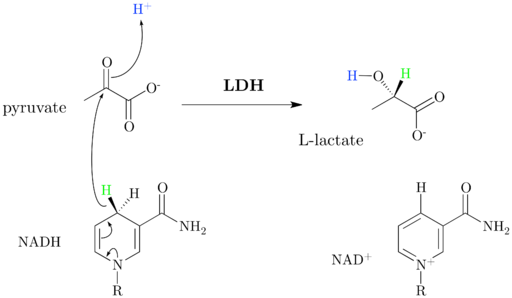 Schema und Reaktionsmechanismus von Dehydrogenase-Lactat (Quelle: JazzlW [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Schema und Reaktionsmechanismus von Dehydrogenase-Lactat (Quelle: JazzlW [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Der nad+ Es hat eine ADP -Einheit und eine andere nukleotische Gruppe, die von Nicotinsäure abgeleitet ist, auch Niacin oder Vitamin B genannt3, Und dieses Coenzym beteiligt sich an mehreren Reaktionen von großer biologischer Bedeutung.
Es ist wichtig zu hervorheben, dass das Gleichgewicht in dieser Reaktion zur Seite verdrängt wird, die dem Laktat entspricht, und es wurde gezeigt, dass das Enzym auch andere Säuren oxidieren kann (S) -2 -hydroximonocarboxylisch und verwendet, wenn auch weniger effizient NADP+ als Substrat.
Abhängig von der Körperregion, die berücksichtigt wird, und gleichzeitig ihre metabolischen Eigenschaften in Bezug auf das Vorhandensein oder Fehlen von Sauerstoff produzieren die Gewebe unterschiedliche Mengen an Laktat, das Produkt der von der LDH katalysierten Reaktion.
Wenn beispielsweise eine rote Blutkörperchen (Erythrozyte), deren Mitochondrien fehlen, das das während der Glykolyse produzierte Pyruvat zu CO metabolisieren kann2 Und dann könnte man sagen, dass dies das Hauptlaktat ist, das Zellen im menschlichen Körper produziert, da das gesamte Pyruvat durch die Wirkung des Dehydrogenase -Laktats in Laktat umgewandelt wird.
Andererseits sind diese, wenn die Leberzellen und Zellen des Skelettmuskels in Betracht gezogen werden.
Kann Ihnen dienen: Sabouraud Agar: Was ist, Fundament, Vorbereitung, verwendetNormalwerte
Die Konzentration der Laktatdehydrogenase im Blutserum ist das Produkt der Expression mehrerer Isoenzyme in Leber, Herz, Skelettmuskel, Erythrozyten und Tumoren unter anderem.
Im Blutserum liegen die normalen Aktivitätsbereiche des Dehydrogenase -Laktats zwischen 260 und 850 U/ml (Einheiten pro Milliliter) mit einem Durchschnittswert von 470 ± 130 U/ml. Inzwischen haben bluthämoralisierte LDH -Aktivität, die zwischen 16 variiert.000 und 67.000 u/ml, was durchschnittlich 34 entspricht.000 ± 12.000 u/ml.
Was bedeutet es, eine hohe LDH zu haben??
Die Quantifizierung der Konzentration von Laktatdehydrogenase im Blutserum hat einen wichtigen Wert bei der Diagnose einiger Herz, Leber, Blutkrankheiten und sogar Krebsarten.
Bei Patienten mit Myokardinfarkten (sowohl experimentell als auch klinisch) sowie bei Krebserkrankungen, insbesondere bei Frauen mit Endometriumkrebs, Eierstöcken, Brust und Uterus, wurden hohe LDH -Aktivitätszahlen gefunden.
Abhängig von dem jeweiligen Isoenzym, das sich in „überschüssigem“ oder hoher Konzentration befindet, wird die Quantifizierung der Isoenzyme des Dehydrogenase -Laktats von vielen behandelnden Ärzten zur Bestimmung von Verletzungen an den Geweben verwendet (schwerwiegend oder chronisch).
Verweise
- Bergmeyer, h., Gebogen, e., & Hess, b. (1961). Laktische Dehydrogenase. Methoden der enzymatischen Analyse. Seelag Chemie, GmbH.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Genomorganisation des menschlichen Lactat-Dehydrogenase-A-Gens. Journal Biochemical, 231, 537-541.
- Becker, d. (2003). Laktatazidose. Intensivpflege Med, 29, 699-702.
- Sogar, j., & Kaplan, n. (1973). Laktatdehydrogensen: Struktur und Funktion. In Fortschritte in der Enzymologie und verwandten Bereichen der molekularen Biologie (pp. 61-133).
- Fox, s. Yo. (2006). Menschliche Physiologie (9. Aufl.). New York, USA: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bosuyt, p. M. M. (1997). Der klinische Wert der Laktat -Dehydrogenase im Serum: eine quantitative Überprüfung. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Nomenklaturkomitee der Internationalen Union für Biochemie und Molekularbiologie (NC-IBMB). (2019). Von www abgerufen.Qmul.AC.UK/SBCS/IUBMB/Enzym/Index.Html
- Rawn, j. D. (1998). Biochemie. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-gomez, m., Dochte, r. W., & Warshaw, m. (1979). Immunochemische Bestimmung des Herzisoenzyms der Laktatdehydrogenase (LDH1) im menschlichen Serum. Clin Chem, 25(5), 729-734.
- Wróblewski, f., & Ladue, j. S. (1955). Laktik -Degydrogenase -Aktivität im Blut. Versuchsbiologie und Medizin, 90, 210-215.
- « Páramo -Eigenschaften, Typen, Flora, Fauna, Beispiele
- Apolipoprotein und Eigenschaften, Funktionen, Krankheiten »

