Leucineigenschaften, Struktur, Funktionen, Biosynthese
- 1371
- 150
- Lewis Holzner
Der Leucin Es ist eine der 22 Aminosäuren, die die Proteine lebender Organismen bilden. Dies gehört zu einer der 9 essentiellen Aminosäuren, die nicht vom Körper synthetisiert werden und mit Lebensmitteln konsumiert werden müssen, die in der Ernährung aufgenommen werden.
Leucina wurde erstmals 1818 vom französischen Apotheker und Chemiker beschrieben. L. Proust, der es "oxidkasend" nannte. Später stellten Erlenmeyer und Kunlin es aus α-Benzoilamido-β-Isopropilacylsäure her, deren molekulare Formel C6H13NO2NO2 ist.
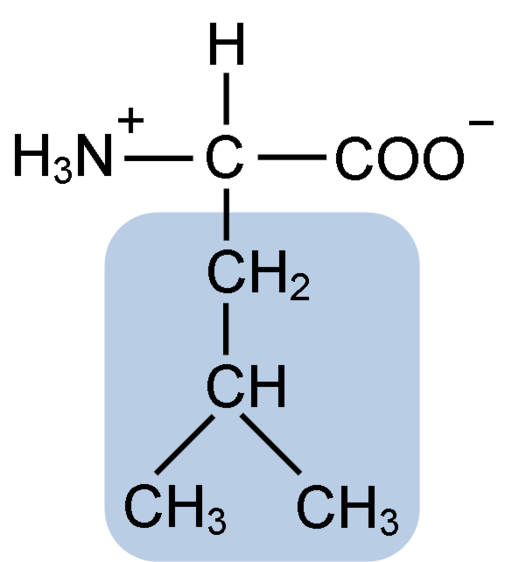
 Chemische Struktur der Leucinaminosäure (Fuene: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons)
Chemische Struktur der Leucinaminosäure (Fuene: Clavecin [CC BY-SA 4.0 (https: // creativecommons.Org/lizenzen/by-sa/4.0)] über Wikimedia Commons) Leucin war der Schlüssel während der Entdeckung des Gefühls der Proteintranslation, da seine hydrophobe Struktur dem Biochemisten Howard Dentzis den Wasserstoff von Kohlenstoff 3 radioaktiv markieren und die Bedeutung beobachten, in der Aminosäuren in die Peptidsynthese von Hämoglobin eingebaut sind.
Die als "Reißverschluss" oder "Verschlüsse" von Leucina bekannten Proteine sind zusammen mit den "Zinkfingern" die wichtigsten Transkriptionsfaktoren eukaryotischer Organismen. Leucin -Reißverschlüsse sind durch ihre hydrophoben Wechselwirkungen mit DNA gekennzeichnet.
Im Allgemeinen werden die Proteine, die reich an Leucin reich oder aus verzweigten Aminosäuren bestehen, in der Leber nicht metabolisiert. Stattdessen gehen sie direkt zu den Muskeln.
Leucin ist eine Aminosäure der verzweigten Kette, die für die Biosynthese der Proteine und Aminosäuren von Milch erforderlich ist, die in den Brustdrüsen synthetisiert werden. Sie können große Mengen dieser freien Aminosäure in der Muttermilch finden.
Unter allen Aminosäuren, aus denen Proteine besteht.
[TOC]
Eigenschaften
Leucin ist als wesentliche Aminosäure der verzweigten Kette bekannt. Sie teilt die typische Struktur mit den anderen Aminosäuren. Es wird jedoch unterschieden, da die Seitenkette oder die R -Gruppe zwei Kohlenstoffe miteinander verbunden ist und die letzte mit einem Wasserstoffatom und zwei Methylgruppen verbunden ist.
Es gehört zur Gruppe der polaren Aminosäuren ohne Last, die Substituenten oder R -Gruppen dieser Aminosäuren sind hydrophob und nichtpolar. Diese Aminosäuren sind die Hauptverantwortung für intra-protische hydrophobe Wechselwirkungen und neigen dazu, die Struktur von Proteinen zu stabilisieren.
Alle Aminosäuren mit einem zentralen Kohlenstoff, der chiral ist (Kohlenstoff α), dh es hat vier verschiedene vereinigte Substituenten, sie können auf zwei verschiedene Arten in der Natur gefunden werden; Somit gibt es D- und L-Leucina, letztere typisch für Proteinstrukturen.
Beide Formen jeder Aminosäure haben unterschiedliche Eigenschaften, nehmen an verschiedenen Stoffwechselstrecken teil und können sogar die Eigenschaften der Strukturen verändern, zu denen sie gehören.
Zum Beispiel hat Leucin in L-Leucina einen etwas bitteren Geschmack, während es in seiner D-Leucin-Form sehr süß ist.
Die Form einer Aminosäure ist leichter durch den Körper von Säugetieren zu metabolisieren. L-Leucina ist leicht abzubauen und für den Bau und den Schutz von Proteinen ausgenutzt.
Struktur
Leucin besteht aus 6 Kohlenstoffatomen. Der zentrale Kohlenstoff, der in allen Aminosäuren häufig ist.
Kann Ihnen dienen: MesothelioKohlenstoffatome in Aminosäuren können mit griechischen Buchstaben identifiziert werden. Die Nummerierung beginnt mit dem Kohlenstoff des Carbonsäure (COOH), während die Annotation mit dem griechischen Alphabet vom zentralen Kohlenstoff beginnt.
Leucin hat als Substituent-Gruppe in seiner R-Kette R zu einer Isobutyl- oder 2-Methylpropil-Gruppe, die durch den Verlust eines Wasserstoffatoms mit der Bildung eines Alkylradikals erzeugt wird. Diese Gruppen erscheinen als Auswirkungen in der Aminosäurstruktur.
Funktionen
Leucin ist eine Aminosäure, die als ketogener Vorläufer anderer Verbindungen dienen kann, die am Zitronensäurezyklus beteiligt sind. Diese Aminosäure ist eine wichtige Quelle für die Synthese von Acetyl-CoA oder Acetoacetyl-CoA, die Teil der Formationsrouten der Ketonkörper in Leberzellen sind.
Es ist bekannt, dass Leucin in Insulinsignalwegen, die am Beginn der Proteinsynthese beteiligt sind, unverzichtbar ist und den Proteinverlust aufgrund des Abbaus vermeidet.
Normalerweise bestehen die inneren Strukturen von Proteinen aus hydrophoben Aminosäuren wie Leucin, Valin, Isoleucin und Methode. Solche Strukturen werden normalerweise für gemeinsame Enzyme unter lebenden Organismen konserviert, wie im Fall von Cytochrom C.
Leucin kann Stoffwechselwege in Brustdrüsenzellen aktivieren, um die Lactose -Synthese, Lipide und Proteine zu stimulieren, die Funktionen wie Signalmoleküle bei der Regulation der Energiehomöostase der Jungen bei Säugetieren erfüllen.
Leucinreiche Domänen sind ein wesentlicher Bestandteil spezifischer DNA -Bindungsproteine, die im Allgemeinen auf eingeschriebene Weise strukturelle Durchmesser sind und als "Leucin -Reißverschlussproteine" bezeichnet werden.
Diese Proteine haben ein charakteristisches Merkmal ein regelmäßiges Muster von wiederholten Leucinen zusammen mit anderen hydrophoben Aminosäuren, die für die Regulierung der Gewerkschaften von Transkriptionsfaktoren zu DNA und zwischen verschiedenen Transkriptionsfaktoren verantwortlich sind.
Leucin-Zip-Proteine können Homo-or-Heterodimere bilden, die es ihnen erlauben.
Biosynthese
Alle verzweigten Kettenaminosäuren, einschließlich Leucin, werden hauptsächlich in Pflanzen und Bakterien synthetisiert. In Blütenpflanzen ist die Leucinproduktion signifikant zugenommen, da es ein wichtiger Vorläufer für alle Verbindungen ist, die für das Aroma von Blumen und Früchten verantwortlich sind.
Einer der Faktoren, die auf die große Häufigkeit von Leucin in den verschiedenen bakteriellen Peptiden zurückzuführen sind.
Leucin wird in Bakterien aus einer Fünf -STEP -Route synthetisiert, die als Ausgangspunkt ein Ketazid verwendet.
Dieser Prozess wird alosterisch von reguliert, so dass bei einem Überschuss an Leucin innerhalb des Zellulars die Enzyme, die an der Strecke beteiligt sind, hemmt und die Synthese stoppt.
Kann Ihnen dienen: Simpson Index: Formel, Interpretation und BeispielBiosinthetische Route
Die Biosynthese von Leucin in Bakterien beginnt mit der Umwandlung eines Derivatketazid -Coa und Wasser für diesen Zweck.
Das (2S) -2-isopropilmalaat verliert ein Wassermolekül und wird durch 3-Isopropylmalat-Dehydratase in 2-Isopropilmaleat umgewandelt. Anschließend fügt das gleiche Enzym ein weiteres Wassermolekül hinzu und verwandelt die 2-Isopropilmaleato in (2R-3s) -3-Isopropilm.
Die letztere Verbindung ist einer Oxidorreduktionsreaktion ausgesetzt, die die Beteiligung eines NAD+-Molekül.
Die (2S) -2-Osopropyl-3-Oxosukkination verliert spontan ein Kohlenstoffatom, wodurch das 4-methyl-2-oxopentanoat erzeugt wird, das durch Wirkung einer Transaminase verzweigter Kette Aminosäuren (Transaminase-Leucin) (insbesondere durch eine Transaminase) (insbesondere durch Transaminase) (insbesondere durch Transaminase) (insbesondere durch Transaminase) (insbesondere durch) Und mit der gleichzeitigen Befreiung von L-Glutamat und 2-Oxoglutarat produziert es L-Leucina.
Degradierung
Die Hauptaufgabe von Leucin ist es, als Signalübertragung zu wirken, die der Zelle sagt, dass es ausreichende Aminosäuren und Energie gibt, um die Synthese von Muskelproteinen zu beginnen.
Der Abbau von verzweigten Kettenaminosäuren als Leucin beginnt mit einer Transaminierung. Diese und die beiden nachfolgenden enzymatischen Schritte werden durch die drei Enzyme im Fall von Leucin, Isoleucin und Valin katalysiert.
Die Transaminierung der drei Aminosäuren erzeugt die α-ecotoacidischen Derivate dieser, die einer oxidativen Decarboxylierung ausgesetzt sind, um Acyl-CoA-Thioés zu erzeugen, die α, β-Dishydydrogeniert sind, um Thioés de Acil-CoA α, β-eingesättigtes β-Einsättigte durchzuführen.
Während des Leucinkatabolismus, der entsprechenden Acyl-CoA-Enthüllung, β-isgesättigter β-Insiba (HMG-CoA), das in Cholesterinbiosynthese und anderen Isoprenoiden intermediär ist.
Katabolischer Route von Leucina
Aus der Bildung des Acyl-CoA-Onkels α, β-isuriert, das aus dem Leucin die katabolen Wege dieser Aminosäure und des Valins und des Isoleucin erheblich abweist.
Das acyl-CoA-Ucion α, β-isgesättigte Leucina wird stromabwärts durch drei verschiedene Enzyme verarbeitet -Coa liasa.
In Bakterien sind diese Enzyme für die Umwandlung von 3-methylcrotonyl-coA (Leucinderivat) in 3-methylglutaconil-CoA, in 3-Hydroxy-3-methylglutaril-CoA und bei Acetoacetat bzw. Acetyl-CoA verantwortlich.
Das im Blut verfügbare Leucin wird für die Synthese von Muskel-/myofibrillären Proteinen (MPS) ausgenutzt. Dies wirkt als aktivierender Faktor dieses Prozesses. Außerdem direkt mit Insulin interagieren und die Versorgung des
Leucine Rich Foods
Der Verbrauch von reichen Aminosäureproteinen ist für die zelluläre Physiologie lebender Organismen unverzichtbar und Leucin ist keine Ausnahme bei wesentlichen Aminosäuren.
Proteine, die aus Milchserum erhalten wurden, gelten als die reichsten in L-Leucina-Resten. Alle Lebensmittel mit hohem Proteingehalt wie Fisch, Hühnchen, Ei und rotem Fleisch liefern jedoch große Mengen Leucin für den Körper.
Kann Ihnen dienen: Reproduktion von Viren: Phasen und EigenschaftenDer Mais in Getreide ist in Lysin- und Tryptophan -Aminosäuren schlecht, er hat sehr starre Tertiärstrukturen für die Verdauung und hat einen geringen Wert aus der Nährstoffsicht. Es hat jedoch ein hohes Maß an Leucin und Isoleucin.
Die Früchte von Hülsenfrüchten sind reich an fast allen wesentlichen Aminosäuren: Lysin, Treonin, Isoleucin, Leucin, Phenylalanin und Valin, haben jedoch einen geringen Gehalt an Methode und Cystein nur wenig.
Leucin wird extrahiert, gereinigt und in Tabletten als Nahrungsergänzungsmittel für hohe Wettbewerbsportler konzentriert und als Medikament vermarktet. Die Hauptquelle für die Isolierung dieser Aminosäure entspricht den Soja -Soja -Mehl.
Es gibt ein Nahrungsergänzungsmittel, der von Athleten zur Muskelregeneration als BCAA (Englisch "verwendet wirdVerzweigtkettige Aminosäure "). Dies liefert hohe Konzentrationen an verzweigten Kettenaminosäuren: Leucina, Valina und Isoleucin.
Vorteile Ihrer Aufnahme
Leucin -reiche Lebensmittel helfen, Fettleibigkeit und andere Stoffwechselerkrankungen zu kontrollieren. Viele Ernährungswissenschaftler weisen darauf hin, dass Lebensmittel, die reich an Leucin- und Ernährungsergänzungsmitteln auf dieser Aminosäure sind, zur Regulierung von Appetit und Angst bei Erwachsenen beitragen.
Alle Leucin -reichen Proteine stimulieren die Muskelproteinsynthese; Es wurde gezeigt, dass ein Anstieg des Anteils des aufgenommenen Leucin in Bezug auf die anderen essentiellen Aminosäuren die Abschwächung der Proteinsynthese bei der Muskulatur älterer Patienten umkehren kann.
Sogar Menschen mit schweren Makula -Störungen, die gelähmt sind.
Leucin, Valin und Isoleucin sind wesentliche Bestandteile der Masse, die den Skelettmuskel von Wirbeltieren ausmachen.
Mangelerkrankungen
Die Mängel oder Fehlbildungen des Dehydrogenase-Komplexes α-Zo-Stoff, der für die Metabolisierung von Leucin, Valin und Isoleucin beim Menschen verantwortlich ist, können schwere psychische Störungen verursachen.
Darüber hinaus gibt es einen pathologischen Zustand im Zusammenhang mit dem Stoffwechsel dieser verzweigten Aminosäuren, die als "Urinkrankheit mit ARCE -Sirupgeruch" bezeichnet werden.
Bisher wurde nicht nachgewiesen. Es wird jedoch eine maximale Dosis von 550 mg/kg täglich empfohlen.
Verweise
- Álava, m. D. C., Camacho, m. UND., & Delgadillo, j. (2012). Muskelgesundheit und Prävention von Sarkopenie: die Wirkung von Protein, Leucin und ß-Hydroxy-ß-Methylbutirat. Knochen- und Mineralstoffwechselmagazin, 10(2), 98-102.
- Phenhem, oder. R. (1993). Lebensmittelchemie (NEIN. 664: 543). Appellieren.
- Massey, l. K., Sokatch, j. R., & Conrad, r. S. (1976). Aminosäure-Katabolismus in verzweigter Kette in Bakterien. Bakteriologische Bewertungen, 40(1), 42.
- Mathews, c. K., & Ahern, k. G. (2002). Biochemie. Pearson Ausbildung.
- Bloß, a. (1999). Leucin -Supplementierung und intensives Training. Sportmedizin, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Säugetier -Proteinstoffwechsel (Vol. 4). Elsevier
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehninger Prinzipien der Biochemie. Macmillan.

