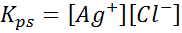Massenaktionsgesetz

- 3651
- 1124
- Said Ganzmann
 Eine Niederschlagsreaktion beinhaltet das Gleichgewicht der Löslichkeit, das vom Massenaktionsgesetz bestimmt wird
Eine Niederschlagsreaktion beinhaltet das Gleichgewicht der Löslichkeit, das vom Massenaktionsgesetz bestimmt wird Was ist das Massenaktionsgesetz??
Der Massenaktionsgesetz erklärt, dass die Geschwindigkeit einer Reaktion von der Konzentration ihrer Reaktanten abhängt, die zu ihren stöchiometrischen Koeffizienten angehoben werden. Dieses Gesetz ermöglicht es, die Konzentrationen im Gleichgewicht der Reaktanten und Produkte einer reversiblen chemischen Reaktion miteinander in Beziehung zu setzen. Mit anderen Worten, es legt die Formel der Gleichgewichtskonstante fest.
Das Massenaktionsgesetz wurde von den norwegischen (und cremefarbenen) Chemikern Cato m ausgesprochen. Guldberg (1836-1902) und Peter Waage (1833-1900) 1864. Dies ist eines der grundlegenden Gesetze der Chemie, da es uns ermöglicht, die Endkonzentrationen im Gleichgewicht aus den Anfangsmengen zu berechnen.
Darüber hinaus ermöglicht das Massengesetz uns auch, die Auswirkungen von Änderungen der Konzentrationen einer der Arten im Gleichgewicht leicht zu verstehen. Mit anderen Worten, wir können verstehen, wie Le Chatliers Prinzipien funktionieren.
Trotz des als "Mass Action Law" bezeichneten Gesetzes bezieht es sich nicht wirklich auf die Massen der Reaktanten und Produkte, sondern auf ihre Konzentrationen. Der Grund, der als Mass Action -Gesetz und nicht das Konzentrationsgesetz bezeichnet wird, liegt darin, dass die Konzentration früher als "aktive Masse" bezeichnet wurde.
Das Massenaktionsgesetz und die Gleichgewichtskonstante
Nach dem Massenaktionsgesetz, wenn reversible Reaktionen das Gleichgewicht erreichen, liegt es nicht daran, dass die Reaktion aufhört. Im Gegenteil wird das Gleichgewicht erreicht, wenn die Geschwindigkeit der direkten Reaktion gleich der Geschwindigkeit der inversen Reaktion erfolgt. In diesem Fall treten alle chemischen Arten auf und werden mit der gleichen Geschwindigkeit konstant, so dass ihre Konzentrationen konstant werden (sie hören nicht mehr zu verändern).
Kann Ihnen dienen: Toluol: Struktur, Eigenschaften, Verwendungen, ErhaltenGuldberg und Waage entdeckten, dass die Geschwindigkeiten beider Reaktionen (direkt und inverser) von der molaren Konzentration (in mol/l) von ihren Reagenzien abhängen, die zu den stöchiometrischen Koeffizienten erhöht wurden. Aus diesen Beobachtungen gelang es ihnen, die Formel für die Gleichgewichtskonstante zu finden.
Nach diesem Gesetz für jede reversible chemische Reaktion, die das Gleichgewicht erreicht,
„… Die Beziehung zwischen dem Produkt der molaren Konzentrationen der Produkte, die zu ihren stöchiometrischen Koeffizienten angehoben werden."
Diese Konstante wird als "Gleichgewichtskonstante" bezeichnet und wird mit dem K -Symbol dargestelltC.
Die Gleichgewichtskonstante Formel
Mal sehen, wie die vorherige Aussage in Form einer mathematischen Gleichung aussieht. Es handelt sich um eine reversible chemische Reaktion wie die unten dargestellte, wobei A und B die Reaktanten sind, C und D die Produkte und A, B, C und D die jeweiligen stöchiometrischen Koeffizienten der ausgewogenen Reaktion:
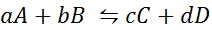
Für eine generische Reaktion wie diese ist die Gleichgewichtskonstante gegeben durch:
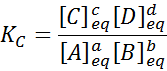
Wo [a], [b], [c] und [d] die molaren Konzentrationen von A, B, C und D im Gleichgewicht sind.
Das Gleichgewicht konstant im Druck
Die vorherige Formel für die Gleichgewichtskonstante gilt für jede chemische Reaktion, bei der sich alle Substanzen in derselben Phase befinden (dh, dass sie sich alle in wässriger Phase oder in einer Gasphase befinden). Bei Gasphasenreaktionen ist es jedoch bequemer, mit Drücken zu arbeiten als mit Konzentrationen.
Da die molare Gaskonzentration proportional zu ihrem Teildruck ist, kann die Formel der Gleichgewichtskonstante in Bezug auf diese Drucke wie folgt umgeschrieben werden:
Es kann Ihnen dienen: 30 Verwendung von Carboxsäuren im Alltag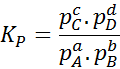
Wo pZU, PB, PC Und PD Sie sind der Teildruck von A, B, C und D und A, B, C und D bleiben die stöchiometrischen Koeffizienten. In diesem Fall kP Es wird als konstantes Gleichgewicht im Druck bezeichnet und ist mit K verwandtC Durch die folgende Formel:
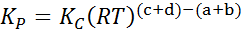
wobei R die universelle Konstante der idealen Gase ist und T die absolute Temperatur in Kelvin ist.
Reaktionen mit mehr als einer Phase
Manchmal beinhaltet eine chemische Reaktion die Bildung eines Feststoffs als Niederschlag aus einer Lösung oder die Bildung einer Flüssigkeit aus Reaktanten, die in einer Gasphase reagieren. In diesen Fällen erfolgt die Reaktion nicht in derselben Phase, daher müssen wir die Gleichgewichtskonstante Formel ändern.
Glücklicherweise sind Modifikationen sehr einfach. Das einzige, was wir beim Schreiben der Formel der Gleichgewichtskonstante berücksichtigen müssen, ist, dass die reinen Substanzen, die als Feststoffe oder Flüssigkeiten erscheinen. Wenn nötig, platzieren wir stattdessen eine 1.
Zusammenfassend lässt sich sagen. Nach dem Kennen eines der beiden ist der andere von Anfang an gefunden werden.
Schließlich müssen wir vorsichtig sein und die Phase überprüfen, in der alle chemischen Arten gefunden werden, um zu wissen, ob wir sie in die Gleichgewichtskonstante aufnehmen müssen oder nicht.
Beispiele für die Verwendung des Massenaktionsgesetzes
In den folgenden Beispielen zeigen wir, wie Sie das Massenaktionsgesetz verwenden, um die Formeln von Gleichgewichtskonstanten für verschiedene Arten von chemischen Reaktionen zu schreiben.
Reaktionen von Reaktionen im gasförmigen Zustand
Beispiel 1: Die Zerlegung von n2ENTWEDER4 in einer Gasphase
Dann2ENTWEDER4 Es ist ein braunes Gas, das gemäß der folgenden Reaktion zusammenbricht:
Es kann Ihnen dienen: Láursäure: Struktur, Eigenschaften, Verwendung, Vorteile, Effekte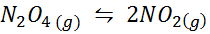
 NO2 -Probe bei unterschiedlichen Temperaturen, die die Verschiebung des Gleichgewichts auf den braunen N2O4 zeigen
NO2 -Probe bei unterschiedlichen Temperaturen, die die Verschiebung des Gleichgewichts auf den braunen N2O4 zeigen Für diese Reaktion werden die Gleichgewichtskonstanten in Konzentrationen und Druckern angegeben:
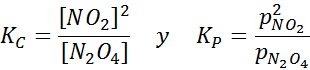
Beispiel 2: Die Oxidation von Kohlenmonoxid
Kohlenmonoxid ist ein sehr giftiges Gas, das bei der Reaktion mit Sauerstoff gemäß der folgenden Reaktion Kohlendioxid werden kann:
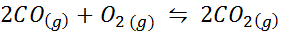
Für diese Reaktion werden die Gleichgewichtskonstanten in Konzentrationen und Druckern angegeben:
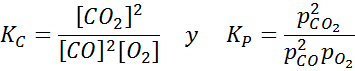
Säure-Base-Balancen in wässriger Phase
Beispiel 3: Wasser selbst -Länge
Das ionische Gleichgewicht des Wassers, auch als Wasserlängenreaktion bekannt, ist eine reversible Reaktion zwischen zwei Wassermolekülen in einem flüssigen Zustand. Die Reaktion ist:
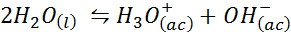
Beim Schreiben der Gleichgewichtskonstante für diese Reaktion müssen wir berücksichtigen, dass in diesem Fall das einzige Reagenz eine reine Flüssigkeit ist, deren Konzentration praktisch konstant ist. Aus diesem Grund ist es nicht in der Formel der Gleichgewichtskonstante enthalten:
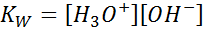
Dies ist eine sehr wichtige Gleichgewichtskonstante, die seinen eigenen Namen (Konstante des ionischen Produkts von Wasser) und sein eigenes Symbol (k) erhältW. W bezieht sich auf Englisch auf Englisch, was gesagt wird Toilette). Es ist jedoch eine Konstante des Gleichgewichts in Konzentrationen wie jeder andere.
Löslichkeitsbilanz
Beispiel 4: Silberchloridlöslichkeitsbilanz
Wenn wir eine gesättigte Lösung vorbereiten, wird ein Löslichkeitsbilanz festgelegt. In diesem Fall ist das Gleichgewicht der der Auflösung des Silberchlorids, dessen Reaktion angegeben wird:
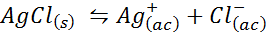
Die Gleichgewichtskonstante dieser Reaktion (und aller Lösungsreaktionen) enthält kein Silberchlorid (AGCL), da sie ein Feststoff ist. Darüber hinaus erhalten diese Konstanten, wie im Fall von Wasser$: