Avogadro -Gesetz
- 2515
- 736
- Tizian Liebich
Was ist Avogadro -Gesetz??
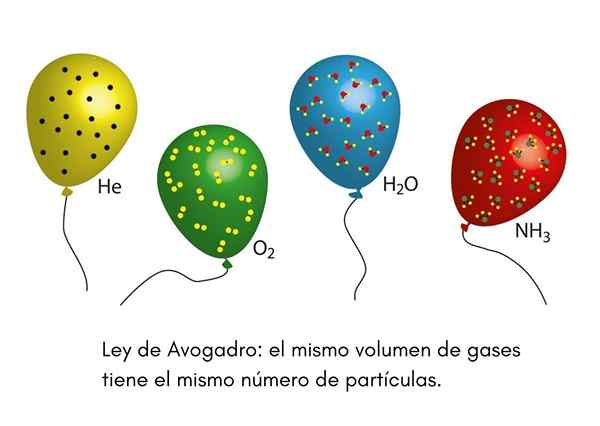
Der Avogadro -Gesetz, Es ist auch ein Avogadro -Prinzip, es ist ein Gesetz, das für ideale Gase gilt und von einem 19. Jahrhundert -Wissenschaftler namens Amadeo Avogadro ausgesprochen wurde. Dieses Gesetz legt fest, dass zwei gleiche Volumina verschiedener Gase, die unter den gleichen Temperatur- und Druckbedingungen liegen.
Dies bedeutet, dass, wenn wir zwei Luftballons haben, eine voll mit Helium und die andere mit Sauerstoff, und beide Luftballons das gleiche Volumen, den gleichen Druck und die gleiche Temperatur haben, dann wird es in der ersten die gleiche Anzahl von Gasheliumatomen geben Globus, die Sauerstoffmoleküle in der zweiten haben.
Avogadro -Rechtsformel
Eine andere Möglichkeit, das Avogadro -Gesetz zu sagen, besteht darin, zu sagen, dass das Volumen eines Gas. Dies wird in mathematischer Weise als:
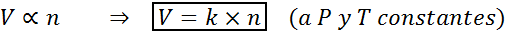
Diese Formel kann nach V/N = K neu ordnet werden, dh die Beziehung zwischen dem Volumen und der Anzahl der Mol bleibt konstant, wenn P und T konstant sind.
Wenn wir also eine bestimmte Menge Gas aus einem Container, die P und T konstant hält, einführen oder entfernen, ändert sich das Volumen und der anfängliche und endgültige Zustand wird mithilfe der folgenden Gleichung verwandt:

Bedingungen, unter denen das Avogadro -Gesetz erfüllt ist
Dieses Gesetz gilt genau für ideale Gase. Dies sind Gase, die von bestimmten Partikeln gebildet werden (die kein Volumen im Raum einnehmen), die in keiner Weise miteinander interagieren.
Es kann Ihnen dienen: Biodiesel: Geschichte, Eigenschaften, Typen, Vorteile, NachteileWie der Name schon sagt, existiert diese Art von Gase in der Realität nicht, sondern in unserer Vorstellungskraft. Sie sind eine vereinfachte "Idee" dessen, was wir für ein Gas halten. Es gibt jedoch einige Bedingungen, unter denen sich ein echtes Gas wie Luft ideal verhält: bei sehr niedrigen Drücken und bei sehr hohen Temperaturen.
Die niedrigen Drücke führen dazu, dass das von den Gaspartikeln besetzte Volumen im Vergleich zur Größe des Behälters vernachlässigbar ist.
Unter diesen Bedingungen erfüllen die meisten Gase das Avogadro -Gesetz mit guter Genauigkeit.
Bedeutung des Avogadro -Gesetzes
Einer der wichtigsten Beiträge des Avogadro -Gesetzes war, dass es die Existenz von Elementargasen demonstrieren durfte, die von mehr als einem Atom als O gebildet wurden2 oder h2. Dies trug zum Fortschritt der Atomtheorie bei.
Darüber hinaus ergänzt das Avogadro-Gesetz die Gesetze von Boyle, Charles und Gay-Lussac und kombiniert es mit diesen drei Gesetzen. Das Avogadro-Gesetz erlaubt das Gesetz der idealen Gase, eines der wichtigsten Gesetze in der Chemie.
Andererseits ermöglicht das Avogadro -Gesetz auch die Aufstellung von Beziehungen zwischen Molekulargewichten verschiedener Gase, da dies impliziert.
Kann Ihnen dienen: Natriumnitrat (Nano3): Struktur, Eigenschaften, Verwendungsmöglichkeiten, RisikenMit einzigen Bedauernsproben von zwei Gasen, die Volumina entsprechen, die gleiche Temperatur und Druck entsprechen, kann die Beziehung zwischen seinen Molmassen erhalten werden.
Beispiele für das Avogadro -Gesetz im Alltag
Partyballons
Wir haben jemals einen Clown auf einer Kinderparty gesehen, die Heliumballons aufblase, um sie unter den Kindern zu verteilen. Diese Luftballons sind ungefähr gleicher Temperatur. Wenn zwei Partyballons mit dem gleichen Druck gefüllt sind und beide gleich groß sind, stellt das Avogadro -Gesetz sicher, dass beide Luftballons die gleiche Anzahl von Helium -Maulwürfen haben werden.
Wenn einer der Luftballons größer als der andere ist, hat er ein größeres Volumen und hat nach Avogadro -Gesetz eine größere Menge an Heliumpartikeln im Inneren.
Die Reifen eines Autos
Unabhängig davon, welches Gas sie gefüllt sind, sind die Reifen auf den gegenüberliegenden Seiten eines Autos immer bis zum gleichen Enddruck von etwa 32 psi gefüllt.
Darüber hinaus stellen wir immer sicher, dass beide Gummi gleich sind, sodass sie das gleiche Volumen haben. Nach dem Avogadro -Prinzip können wir also sagen, dass beide Reifen die gleiche Anzahl von Gaspartikeln enthalten.
Eine Spritze voller Luft
Angenommen, wir haben eine offene Spritze und voller 50 cm3 aus Luft. Wie offen ist das Innere der Spritze und des Äußeren (die Umgebung) bei der gleichen Temperatur und dem gleichen Druck.
Nehmen wir nun an, wir drücken den Spritzenkolben und bewegen sie, bis 10 cm gelesen werden3. Wenn die Spritze freigelegt ist, entkommt die Luft durch die Spitze, während sich der Kolben bewegt.
Kann Ihnen dienen: VolatilisationDa sich weder der Druck noch die Temperatur ändern, kann das Avogadro -Gesetz angewendet werden. Diese Beziehung ist:

Wenn wir diese Gleichung neu anordnen, bekommen wir das:
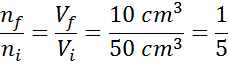
Dieses Ergebnis bedeutet, dass die Anzahl der am Ende des Prozesses vorhandenen Maulwürfe oder Partikel auch der fünfte Teil dessen sein wird.


