Charles Law Formeln und Einheiten, Experiment, Übungen

- 1256
- 46
- Luca Holdt
Der Charles Law oder von Guy-Lussac ist eine, die die Aussage eines der Eigenschaften des gasförmigen Zustands ermöglicht: Das Volumen, das ein Gas einnimmt, ist direkt proportional zur Temperatur bei konstantem Druck.
Diese Verhältnismäßigkeit ist für alle Temperaturbereiche linear, wenn das betreffende Gas ideal ist. Royal Gase hingegen abweicht vom linearen Trend bei Temperaturen in der Nähe ihres Kondensationspunkts ab. Dies hat jedoch die Verwendung dieses Gesetzes für endlose Anträge, an denen Gase teilnehmen, nicht eingeschränkt.
 Chinesische Laternen oder Wünsche. Quelle: pxhere.
Chinesische Laternen oder Wünsche. Quelle: pxhere. Eine der Parzellen von Charles 'Gesetz ist die Präsenz in aerodynamischen Luftballons. Andere einfachere Luftballons wie Wünsche, auch chinesische Lampe genannt.
Warum konstanter Druck? Denn wenn der Druck zunimmt, würde dies bedeuten, dass der Behälter, in dem sich das Gas befindet, fest geschlossen ist. Damit würden die Kollisionen oder Auswirkungen der gasförmigen Partikel gegen die inneren Wände des Containers (Boyle-Maleotte-Gesetz) die Kollisionen oder Auswirkungen der inneren Partikel (Boyle-Maleotte-Gesetz) erhöhen.
Daher würde es keine Änderung des von Gas besetzten Bandes geben, und das Gesetz von Charles wäre nicht streng. Im Gegensatz zu einem hermetischen Behälter stellt das Gewebe der Luftballons der Wünsche eine mobile Barriere dar, die sich abhängig vom Druck des Gass im Inneren ausdehnen oder zusammenziehen kann.
Wenn sich das Ballongewebe jedoch ausdehnt, bleibt der Innendruck des Gase. Je höher die Gastemperatur, desto größer ist die kinetische Energie der Partikel und damit die Anzahl der Kollisionen.
Und wenn sich der Globus erneut ausdehnt, bleiben Kollisionen gegen seine inneren Mauern konstant (idealerweise).
Je heißer das Gas ist, desto größer ist die Ausdehnung des Globus und desto mehr wird es steigen. Das Ergebnis: Rötliche (obwohl gefährliche) Lichter am Himmel in den Nächten im Dezember aufgehängt.
[TOC]
Was ist Charles 'Gesetz??
Stellungnahme
Das sogenannte Charles Law oder Gay-Lussac's Gesetz erklärt die Abhängigkeit, die zwischen dem Volumen besteht, das durch ein Gas besetzt ist und dem Wert seiner absoluten Temperatur oder Kelvin-Temperatur.
Das Gesetz kann wie folgt ausgegeben werden: Wenn der Druck konstant bleibt, wird erfüllt, dass „für eine bestimmte Masse eines Gase ) Das erhöht seine Temperatur ".
Arbeitsplätze
Die Forschungsarbeiten, die das Gesetz ermöglichten, wurden in den 1780er Jahren von Jacques Alexander Cesar Charles (1746-1823) eingeleitet. Charles veröffentlichte jedoch nicht die Ergebnisse seiner Untersuchungen.
Anschließend gelang es John Dalton 1801, experimentell zu bestimmen, dass alle von ihm untersuchten Gase und Dämpfe zwischen zwei entschlossenen Temperaturen im selben Volumen expandieren. Diese Ergebnisse wurden von Gay-Lussac im Jahr 1802 bestätigt.
Die Forschungsarbeiten von Charles, Dalton und Gay-Lussac erlaubten feststellen, dass das von einem Gas und seiner absolute Temperatur besetzte Band direkt proportional sind. Daher besteht eine lineare Beziehung zwischen der Temperatur und dem Volumen eines Gases.
Es kann Ihnen dienen: Methoden zur Trennung heterogener GemischeGraph
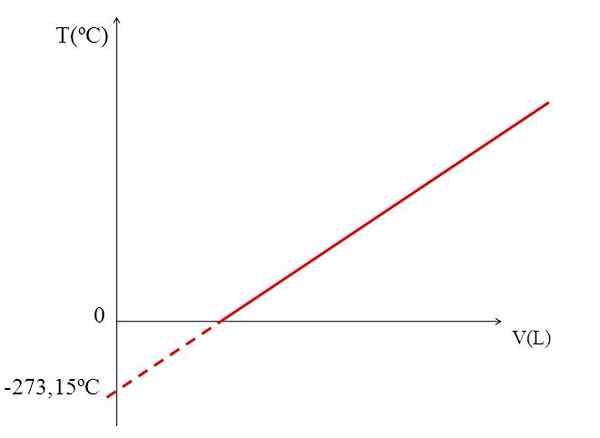 T VS V Graph für ein ideales Gas. Quelle: Gabriel Bolívar.
T VS V Graph für ein ideales Gas. Quelle: Gabriel Bolívar. Die Realisierung eines Diagramms (oberes Bild) des Volumens eines Gases gegen die Temperatur erzeugt eine gerade Linie. Der Schnittpunkt der Linie mit der Achse des x, bei der Temperatur von 0 ° C, ermöglicht es, das Gasvolumen bei 0 ºC zu erhalten.
Ebenso würde der Schnittpunkt der Linie mit der Achse des x Informationen über die Temperatur liefern, für die das vom Gas besetzte Volumen "0" null wäre. Dalton schätzte diesen Wert bei -266 ºC, nahe dem von Kelvin vorgeschlagenen Wert für absolute (0) Absolute.
Kelvin schlug eine Temperaturskala vor, deren Null die Temperatur sein sollte, bei der ein perfektes Gas ein Volumen von Null haben würde. Aber bei diesen niedrigen Temperaturen sind die Gase verflüssigt.
Deshalb können wir nicht über Volumina von Gasen als solche sprechen und feststellen, dass der Wert für absolute Null -273,15 ° C betragen sollte.
Formeln und Messeinheiten
Formeln
Das Charles 'Gesetz in seiner modernen Version zeigt an, dass das Volumen und die Temperatur eines Gases direkt proportional sind.
So:
V / t = k
V = Gasvolumen. T = Kelvin -Temperatur (k). K = Verhältnismäßigkeitskonstante.
Für ein Volumen v1 und eine Temperatur t1
k = v1 / T1
Auch für ein Volumen v2 und eine Temperatur t2
k = v2 / T2
Dann die beiden Gleichungen für k übereinstimmen, haben Sie
V1 / T1 = V2 / T2
Diese Formel kann wie folgt geschrieben werden:
V1 · T2 = V2 · T1
Clearing v2, Die Formel wird erhalten:
V2 = V1 · T2 / T1
Einheiten
Das Gasvolumen kann in Litern oder in einer seiner abgeleiteten Einheiten ausgedrückt werden. Ebenso kann das Volumen in Kubikmeter oder in jeder abgeleiteten Einheit ausgedrückt werden. Die Temperatur muss bei absoluter Temperatur oder Kelvin -Temperatur ausgedrückt werden.
Wenn also die Temperaturen eines Gases in der Skala von Celsius oder Celsius ausgedrückt werden, um eine Berechnung mit ihnen durchzuführen, sollte die Menge von 273,15 ° C zu den Temperaturen hinzugefügt werden, um sie zu absoluten Temperaturen oder Kelvin zu bringen.
Wenn die Temperaturen in Grad Farenheit ausgedrückt werden, sollte sie zu diesen Temperaturen 459,67 ºR hinzugefügt werden, um sie auf die Rankine -Skala auf absolute Temperaturen zu bringen.
Eine weitere bekannte Formel von Charles 'Gesetz und direkt im Zusammenhang mit seiner Aussage ist wie folgt:
VT = Ventweder (1 + t/273)
Wo vT Es ist das Volumen, das von einem Gas bei einer bestimmten Temperatur in Litern, cm ausgedrückt wird3, usw.; und ventweder Es ist das Volumen, das von einem Gas bei 0 ºC besetzt ist. T für seinen Teil ist T die Temperatur, bei der die Volumenmessung durchgeführt wird und in Celsius (ºC) Grad (ºC) ausgedrückt wird.
Und schließlich repräsentiert 273 den absoluten Nullwert auf der Kelvin -Temperaturskala.
Experimentieren, um das Gesetz zu demonstrieren
Montage
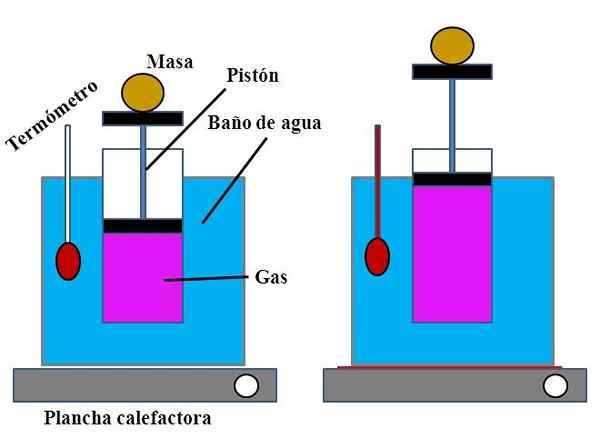 Versammlung des Experiments zur Demonstration von Charles 'Gesetz. Quelle: Gabriel Bolívar.
Versammlung des Experiments zur Demonstration von Charles 'Gesetz. Quelle: Gabriel Bolívar. In einem Wasserbehälter, der die Funktion eines Wasserbades erfüllte, wurde ein offener Zylinder im oberen Teil mit einem Kolben, der sich an die innere Wand des Zylinders eingestellt hat (überlegenes Bild), eingestellt wurde.
Dieser Kolben (gebildet vom Kolben und den beiden schwarzen Basen) könnte sich je nach dem enthaltenen Gasvolumen in den oberen oder unteren Teil des Zylinders bewegen.
Das Wasserbad könnte durch Verwendung einer leichteren oder Heizanlage erhitzt werden, die die Wärme versorgt, die zur Erhöhung der Badezimmertemperatur und damit die Temperatur des mit einem Kolben ausgestatteten Zylinders erhoben wurde.
Kann Ihnen dienen: Calciumhydroxid (CA (OH) 2): Struktur, Eigenschaften, erhalten, verwendet, verwendetAuf dem Kolben wurde eine bestimmte Masse platziert, um sicherzustellen, dass das Experiment bei konstantem Druck durchgeführt wurde. Das Badezimmer und die Zylindertemperatur wurden unter Verwendung eines Thermometers im Wasserbad gemessen.
Obwohl der Zylinder wahrscheinlich keinen Abschluss hatte, um das Luftvolumen zu visualisieren.
Entwicklung
Das Volumen eines Zylinders wird erhalten, indem die Oberfläche seiner Basis mit seiner Höhe multipliziert wird. Die Oberfläche der Zylinderbasis konnte durch Anwenden der Formel erhalten werden: s = pi x r2.
Während die Höhe erhalten wird, indem der Abstand von der Basis des Zylinders zu dem Kolben gemessen wird, auf dem der Teig ruht.
Als die Badezimmertemperatur durch Hitze erhöhte, die vom Feuerzeug erzeugt wurde, wurde beobachtet, dass der Kolben im Zylinder stieg. Dann lesen sie die Temperatur im Wasserbad im Thermometer, die dem Inneren des Zylinders entsprach.
Sie messen auch die Höhe des Teigs am Kolben und können das Luftvolumen abschätzen, das der gemessenen Temperatur entsprach. Auf diese Weise führten sie mehrere Temperaturmessungen und Schätzungen des Luftvolumens durch, die jeder der Temperaturen entsprechen.
Dies könnte schließlich feststellen, dass das von einem Gas besetzte Volumen direkt proportional zu seiner Temperatur ist. Diese Schlussfolgerung ermöglichte, das sogenannte Charles -Gesetz zu sagen.
Globe mit Eis im Winter
Zusätzlich zum vorherigen Experiment gibt es eine einfachere und qualitativere: das des Ballons mit Eis im Winter.
Wenn im Winter ein Ballon voller Helium in einem Raum mit Heizung platziert wurde, hätte der Globus ein bestimmtes Volumen; Wenn jedoch mit niedriger Temperatur nach außen des Hauses bewegt wurde, wird beobachtet, dass der Heliumballon schrumpf.
Gelöste Übungen
Übung 1
Sie haben ein Gas, das ein Volumen von 750 cm einnimmt3 Bei 25 ºC: Was wird das Volumen sein, das dieses Gas bei 37 ° C einnimmt, wenn der konstante Druck aufrechterhalten wird??
Es ist notwendig, zuerst die Temperatureinheiten in Kelvin umzuwandeln:
T1 In Grad Kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 In Grad Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Weil es bekannt ist v1 und die anderen Variablen, es löscht V2 Und es wird mit der folgenden Gleichung berechnet:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Übung 2
Was wäre die Temperatur in Grad Celsius, zu der 3 Liter eines Gases auf 32 ° C erhitzt werden sollten, damit sich sein Volumen auf 3,2 Liter ausdehnt??
Wiederum werden die Celsius -Abschlüsse in Kelvin transformiert:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Und wie in der vorherigen Übung wird T freigegeben2 Statt v2, und berechnet dann:
T2 = V2 · (T1 / V1)
= 3,2 l · (305,15 k / 3 l)
= 325,49 K
Die Aussage fragt jedoch nach Grad Celsius, so dass die Einheit von T geändert wird2:
T2 In Grad Celsius = 325, 49 º C (k) - 273,15 ºC (k)
Kann Ihnen dienen: Pascal -Spritze= 52,34 ºC
Übung 3
Wenn ein Gas bei 0 ºC ein Volumen von 50 cm einnimmt3, Welches Volumen wird es bei 45 ° C einnehmen?
Verwendung der ursprünglichen Formel von Charles 'Gesetz:
VT = Ventweder (1 + t /273)
Fahren Sie fort, um V zu berechnenT Direkt, wenn Sie alle Variablen entsorgen:
VT = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (k)))
= 58,24 cm3
Auf der anderen Seite haben wir: Wenn das Problem anhand der Strategie der Beispiele 1 und 2 gelöst wird, haben wir:
V2 = V1 · (T2 / T1)
= 318 k · (50 cm3 / 273 k)
= 58,24 cm3
Das Ergebnis, das die beiden Verfahren anwendet, ist gleich, da sie letztendlich auf demselben Prinzip des Charles Law beruhen.
Anwendungen
Wishe Galls
Die Luftballons der Wünsche (bereits in der Einführung erwähnt) sind mit einem Textilmaterial ausgestattet, das mit einer brennbaren Flüssigkeit imprägniert ist.
Wenn Brand dieses Material abfeuert.
Durch Erhöhen des Luftvolumens im Globus nimmt die Luftdichte in der Luft ab, die weniger als die Dichte der umgebenden Luft ist, und deshalb steigt der Globus auf.
Popup-Thermometer oder Truthähne
Wie durch seinen Namen angegeben, werden sie während des Kochens von Truthähne verwendet. Das Thermometer hat einen Behälter voller geschlossener Luft mit einem Deckel und wird so kalibriert.
Das Thermometer befindet sich im Truthahn, und wenn die Temperatur im Ofen steigt. Wenn das Luftvolumen also einen bestimmten Wert erreicht.
Wiederherstellung der Form von Ping-Pong-Bällen
Ping-Pong-Kugeln je nach den Anforderungen ihrer Verwendung sind leicht und ihre Kunststoffwände sind wenig dick. Dies lässt sie von den Schlägern betroffen.
Durch das Platzieren der deformierten Kugeln in heißes Wasser wird die Luft im Inneren erhitzt und ihre Expansion tritt auf, was zu einer Erhöhung des Luftvolumens führt. Dies führt auch zu einem Abschnitt der Wand der Ping-Pong-Kugeln, die die Wiederherstellung ihrer ursprünglichen Form ermöglicht.
Ausarbeitung der Paes
Hefen werden in Weizenmehl eingebaut, das zur Herstellung von Brot verwendet wird und die Fähigkeit zur Herstellung von Kohlendioxidgas besitzt.
Durch Erhöhen der Temperatur des Brotes während des Kochens steigt das Volumen des Kohlendioxids. Aus diesem Grund tritt eine Ausdehnung des Brotes auf, bis das gewünschte Volumen erreicht ist.
Verweise
- Clark j. (2013). Oterer Gasgesetze - Boyle's Law und Charles 'Gesetz. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Staroscik Andrew. (2018). Charles 'Gesetz. Abgerufen von: ScientRimer.com
- Wikipedia. (2019). Charles Law. Abgerufen von: in.Wikipedia.Org
- Helmestine, Todd. (27. Dezember 2018). Was ist die Formel für Charles 'Gesetz?? Erholt von: thoughtco.com
- Prof. N. Des Löwen. (S.F.). Elementar Gasgesetze: Charles Law. C 101 Klassennotizen. Erholt von: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Erholt von: euston96.com
- Morris, j. G. (1974). Physikochemie für Biologen. (2gibt Auflage). Editorial Reverté, s.ZU.
- « Vierzehn Punkte des Wilson -Hintergrunds und wie es Deutschland beeinflusste
- Anwendungen der Konzepte Energie, Macht, Stärke, Arbeit »

