Henrys Gesetz

- 933
- 231
- Lewis Holzner
 Henrys Gesetz erklärt die Entlüftung von Erfrischungsgetränken
Henrys Gesetz erklärt die Entlüftung von Erfrischungsgetränken Was ist Henrys Gesetz??
Der Henrys Gesetz Es ist die Beziehung, die den Einfluss des Drucks auf die Gaslöslichkeit beschreibt. Dieses Gesetz legt fest, dass die Löslichkeit eines Gases, das mit der Oberfläche einer Flüssigkeit bei einer bestimmten Temperatur in Kontakt ist.
Dies bedeutet, dass je größer der Gasdruck auf einer Flüssigkeit ist, desto größer ist die Gesamtmenge an Gas, die darin gelöst werden kann, wodurch eine größere Konzentration erreicht wird (dh dh größer die Löslichkeit).
Henrys Gesetz sehen wir es jedes Mal in Aktion, wenn wir ein Soda -Getränk aufdecken. Wenn der hohe Druck in der Flasche geschlossen ist, wird das Kohlenhydratgas aufgelöst. Aber durch das Aufdecken nimmt der Gasdruck ab.
Henry's Law Formel
In mathematischer Form wird das Gesetz von Henry als Gesetz der Verhältnismäßigkeit ausgedrückt:
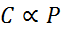
Dieses Verhältnismäßigkeitsgesetz wird verwandelt in:
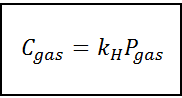
Wo C Es bezieht sich auf die maximale Gaskonzentration in der Flüssigkeit, dh seine Löslichkeit; PGas Es ist der Teildruck von Gas in Kontakt mit der Flüssigkeit und kH Es ist eine Verhältnismäßigkeitskonstante genannt Henrys Gesetz konstant.
Gaskonzentration kann in verschiedenen Einheiten wie Molarität, Molität oder Molfraktion exprimiert werden. In den meisten Fällen verwenden Chemikalien die Konzentration in Molaritätseinheiten (in mol/l), während der Druck in Atmosphären exprimiert wird.
Kann Ihnen dienen: Anthracen: Was ist, Struktur, Eigenschaften, verwendetDie Konstante des Henryschen Gesetzes (kH)
Die Konstante kH Beschreiben Sie die Wechselwirkungen zwischen einem Gas und einem Lösungsmittel. Je stärker diese Wechselwirkungen sind, desto größer ist die Konstante und desto größer die Löslichkeit des Gases im Lösungsmittel bei einer bestimmten Temperatur und einem bestimmten Druck.
Numerisch, der Wert von kH repräsentiert die Löslichkeit des Gases bei der angegebenen Temperatur, wenn der Teildruck desselben 1 atm beträgt.
Abhängig von den in der Gleichung verwendeten Konzentrations- und Druckeinheiten kann diese Konstante mol/l -Einheiten haben.atm, mol/kg.ATM usw.
Die folgende Tabelle zeigt die Werte der Konstante des Henryschen Gesetzes für einige gemeinsame Gase in Wasser bei 25 ° C:

Diese Werte nehmen mit der Temperatur ab, da die Löslichkeit von Gasen im Allgemeinen bei einer höheren Temperatur abnimmt.
Erklärung des Henrys Gesetz
Henrys Gesetz ist aus mikroskopischer Sicht sehr leicht zu verstehen. Wir können uns ein Gas als eine Reihe sehr kleiner Partikel vorstellen, die auf allen Oberflächen, die spielen. Wenn sie mit der Oberfläche einer Flüssigkeit kollidieren, springen einige Partikel ab, während andere die eingeschlossene Oberfläche überqueren (dh sie löst sich auf).
Gleiches gilt für Gaspartikel, die aufgelöst werden. Sie springen mit den Wänden des Behälters und können auch die Oberfläche der Flüssigkeit erreichen, wo einige springen, während andere die Oberfläche überqueren und in die Gasphase fliehen.
Wenn das Gleichgewicht erreicht ist, sind die Geschwindigkeiten, mit denen sich das Gas im Lösungsmittel auflöst.
Kann Ihnen dienen: mechanische Eigenschaften von Metallen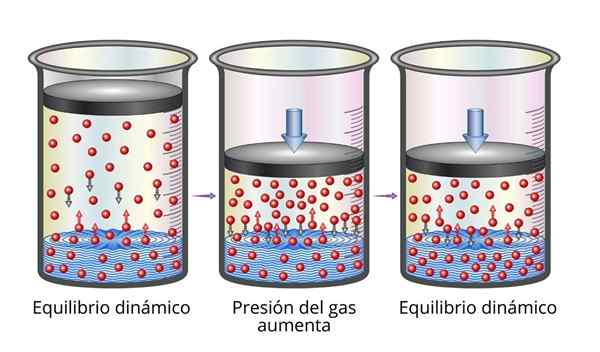 Erklärung des Henrys Gesetz
Erklärung des Henrys Gesetz Wenn wir den Gasdruck erhöhen, erhöhen wir die Frequenz, mit der Gaspartikel mit der flüssigen Oberfläche kollidieren. Dies macht die Geschwindigkeit, mit der sich das Gas auflöst. Wenn ein neues Gleichgewicht erreicht ist, wird die neue Gaskonzentration größer sein.
Ausnahmen vom Henryschen Gesetz
Es ist wichtig hervorzuheben, dass das Henrysche Gesetz ein ideales Gesetz ist, das nur das Verhalten realer Gaslösungen unter bestimmten Bedingungen beschreibt. Somit kann das Henrysche Gesetz nur angewendet werden, wenn:
- Die Temperatur bleibt konstant.
- Das Gas ist mit der Lösung ausgleichen.
- Gasdruck ist relativ niedrig.
- Das Gas reagiert nicht mit dem Lösungsmittel.
Trotzdem kann dieses Gesetz selbst in einigen Fällen, in denen das Gas mit dem Lösungsmittel reagiert, ungefähr angewendet werden.
Beispiele für die Anwendung des Henryschen Gesetzes
Beispiel 1: Bestimmung der Konstante des Henryschen Gesetzes
Es wurde experimentell festgestellt, dass die Konzentration einer wässrigen Lösung im Gleichgewicht mit Neon bei einem Druck von 3,00 atm und 25 ° C 0,00135 mol/l beträgt. Bestimmen Sie die Konstante des Henryschen Gesetzes für Neon in Wasser bei 25 ° C.
Lösung:
Nach Henrys Gesetz:
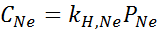
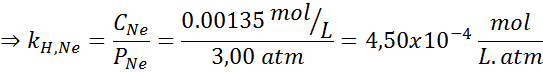
Daher beträgt Henry's Law konstant für Neon in Wasser bei 25 ° C 4,50 × 10-4 mol/l.Geldautomat.
Beispiel 2: Bestimmung der Löslichkeit eines Gases
Unter Verwendung der in der vorherigen Tabelle vorgesehenen Konstante des Henryschen Gesetz-4.
Lösung:
Auf Meereshöhe beträgt der Luftdruck 1 atm und der Teildruck des CO2 Es wird gegeben durch:
Es kann Ihnen dienen: hypoyodöse Säure (HIO)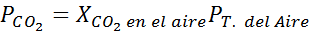
Ersetzen dieses Ausdrucks im Henryschen Gesetz:
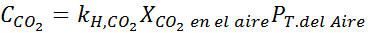
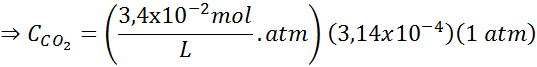
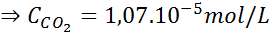
Beispiel 3: Tauchgase
Wenn ein Taucher nichts in Tiefen von mehr als 30 Metern mehr als 30 Metern ist, muss eine Luftmischung mit anderen trägen Gasen wie Helium oder Argon atmen, da die Zunahme der Stickstoffkonzentration im vorhergesagten Blut durch das Henrysche Gesetz narkotische Wirkungen hat, die Desorientierung, Verwirrung und Sehen verursachen Probleme.
Dieser Effekt beginnt zu beobachten, wenn Luft atmet (xN2= 0,78) bei einem Druck von 4,00 atm. Wenn ein Taucher plant, bis zu 100 Meter tief abzusteigen, wobei der Druck etwa 11,0 atm beträgt, was ist die maximale Stickstofffraktion, die atmen kann, bevor er unter Drogenhändlern leidet?
Lösung:
Basierend auf der Aussage können wir ableiten, dass die maximale Stickstoffkonzentration auftritt, wenn der Luftdruck 4,00 atm beträgt. Nach dem Gesetz von Henry und der Verwendung der Beziehung zwischen dem Gesamtdruck und dem Teildruck des vorherigen Beispiels:
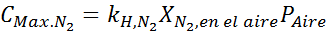
Dies muss bei jedem Gesamtdruck die gleiche maximale Konzentration sein. Also 100 Meter:
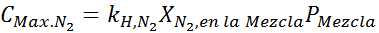
Ausgleich beider Gleichungen können wir den maximalen molaren Anteil von Stickstoff in der Mischung finden:
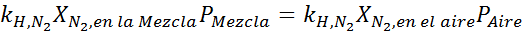
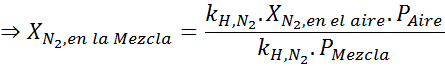
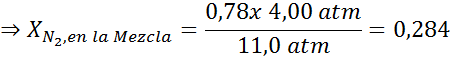
Dies bedeutet, dass der Taucher keine Mischung verwenden sollte, die mehr als 28,4% Stickstoff enthält, wenn er bis zu 100 Meter tief tieft.

