Hess Erklärungsgesetz, Bewerbungen, Beispiele
- 2550
- 158
- René Riediger
Der Hessgesetz Es ist eine weitere Manifestation des Energieschutzgesetzes, das es ermöglicht, durch einfache algebraische Summen die Enthalpie einer chemischen Reaktion zu bestimmen. Durch Enthalpie als Wärme verstanden oder absorbiert, bei konstantem Druck, der mit einer chemischen Reaktion oder einem chemischen Phänomen verbunden ist.
Enthalpien ΔH werden experimentell unter Verwendung der Kalorimetrie bestimmt. Es gibt jedoch Reaktionen, die mit dieser Technik schwer zu untersuchen sind. In diesem Fall werden andere Reaktionen verwendet, die ihre spezifischen Enthalpien haben und die die Interessen oder Verbindungen besitzen, die daran interessiert sind.
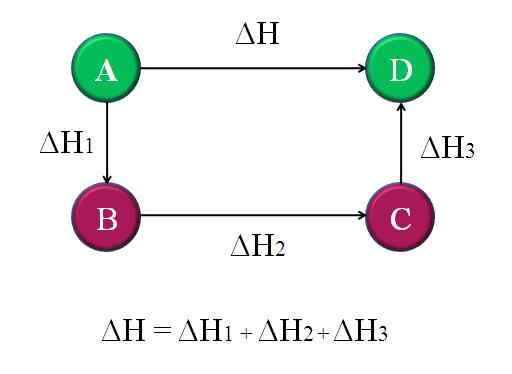
 Einfaches und allgemeines Diagramm, in dem das Hessgesetz für vier chemische Reaktionen angewendet wird. Quelle: Gabriel Bolívar.
Einfaches und allgemeines Diagramm, in dem das Hessgesetz für vier chemische Reaktionen angewendet wird. Quelle: Gabriel Bolívar. Auf diese Weise kann das „unbekannte“ ΔH der Reaktion berechnet werden. Zum Beispiel hilft das obere Diagramm, diese Idee zu verstehen. Es gibt vier Reaktionen: A-D, A-B, B-C und C-D. Die A-D-Reaktion ist diejenige, die das größte ΔH hat, weil sie sozusagen die berüchtigtsten chemischen Veränderungen auftreten.
Die anderen Reaktionen haben zwar kleineres ΔH, da sie aus alternativen Schritten oder alternativen Reaktionen bestehen, um dieselben Produkte zu erreichen D. Daher die Summe von ΔH1, ΔH2 und ΔH3, Es wird gleich ΔH sein. Wenn Sie dies wissen, können ΔH oder eine andere Enthalpie berechnet werden, indem einfache Löschen angewendet werden. Dies ist Hessgesetz.
Das Hess -Gesetz ist sehr nützlich bei der Berechnung von Reaktionsenthalpien sowie bei der Schulung von Enthalpien für verschiedene Verbindungen oder instabile Vermittler.
[TOC]
Erklärung des Hessgesetzes
Berechnung der Enthalpie einer Reaktion
Der Grund, warum es erfüllt ist:
ΔH = ΔH1 + ΔH2 + ΔH3
Es liegt daran, dass Enthalpie oder die Änderung der Enthalpie eine Zustandsfunktion ist. Dies bedeutet, dass ihre Werte nicht durch die Anzahl der Schritte, Stadien oder Vermittlerreaktionen geändert werden. Zum Beispiel bleibt ΔH gleich, selbst wenn es ein ΔH gibt10 Das sollte in der algebraischen Summe berücksichtigt werden.
Enthalpien könnten als die Spitzen einiger Berge sichtbar gemacht werden. Egal wie die Schritte zu ihnen gerichtet sind, die Höhe, die sie von der Mar -Ebene trennt, wird niemals variieren. Und genau sind es die Höhen, die hinzugefügt oder subtrahiert werden, um die unbekannte Höhe eines umliegenden Berges zu bestimmen.
Zurück zum vorherigen Diagramm: a, es ist ein Berg eines anderen Berges und so weiter. Der Höhenunterschied zwischen A- und D -Tops ist der größte. Wenn Sie die Höhen zwischen A-B, B-C und C-D hinzufügen, wird es gleich A-D-Höhe ergeben. Dies ist, was mit den Enthalpien ihrer jeweiligen chemischen Reaktionen getan wird.
Kann Ihnen dienen: PhosphatgruppeEnthalpie einer Reaktion aus Enthalpien von Formationen
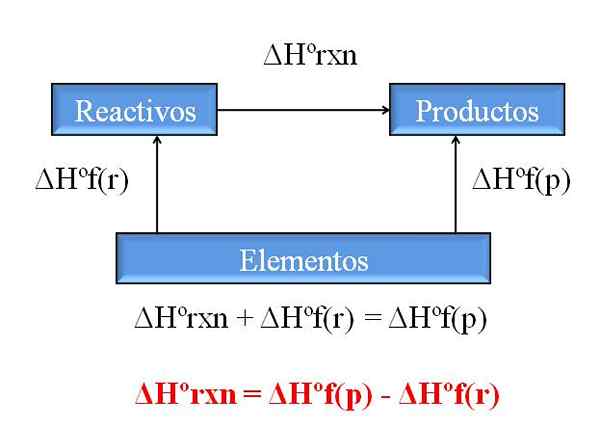 Allgemeines Diagramm zur Berechnung der Enthalpie einer Reaktion aus Enthalpien von Formationen. Quelle: Gabriel Bolívar.
Allgemeines Diagramm zur Berechnung der Enthalpie einer Reaktion aus Enthalpien von Formationen. Quelle: Gabriel Bolívar. Eine der wertvollsten Konsequenzen des Hessgesetzes ist, dass es die Bestimmung der Enthalpien jeglicher chemischer Reaktion ermöglicht und die Schulungsenthalpien aller Verbindungen (Reagenzien und Produkte) nimmt.
Das überlegene Bild zeigt diesen Punkt. Durch Enthalpie der damit verbundenen Wärmebildung verstanden, wenn eine Verbindung aus ihren Elementen gebildet wird. Diese Enthalpie würde zum maximal möglichen Unterschied zwischen Reagenzien und Produkten werden, ohne dass andere chemische Reaktionen konsultieren müssen. Zumindest außerhalb des separaten Trainings von Verbindungen.
Wie lesen Sie diesmal das Diagramm?? Ein Trick besteht immer darin, die Enthalpien hinzuzufügen, wenn sie in die Richtung des Pfeils geht, und sie subtrahieren, wenn sich der Pfeil auf der gegenüberliegenden Route befindet. Somit ergänzt ΔHºrxn, Standardreaktionenthalpie, zu ΔHºF (Reagenzien), Standardenthalpie der Reagenzierung und sie werden ΔHºF (Produkte), Standardenthalpie der Produktbildung von Produkten subtrahiert.
Reaktionen Beträge
Die Diagramme können sehr kompliziert werden zu interpretieren, insbesondere wenn es viele Reaktionen gibt, die berücksichtigt werden müssen. Daher wird die Summe der Reaktionen verwendet. Diese Methode erleichtert die Berechnung von Enthalpien stark und beschleunigt das Verständnis des Hessgesetzes.
Nehmen wir zum Beispiel an, dass Sie die ΔHºrxn der folgenden Reaktion bestimmen möchten:
A + B + C → ABC
Und wir haben auch zwei weitere Reaktionen:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº)2)
Es ist interessant, dass A + B + C auf der linken Seite (Reagenzien) und ABC auf der rechten Seite (Produkte) ist (Produkte). Dann fügen wir einfach die letzten beiden Reaktionen hinzu:
A + b → ab
AB + C → ABC
A + AB + C → ABC + AB
Da AB von beiden Seiten ist, wird es beseitigt. Und so haben wir:
A + B + C → ABC
ΔHºrxn = ΔHº1 + ΔHº2
Wenn Sie die Reaktionen hinzufügen, wird die Verwendung eines Diagramms weggelassen.
Bewerbungen des Hessgesetzes
Das Hess -Gesetz erlaubt es, ohne Experimente nach Enthalpien für unterschiedliche chemische Reaktionen oder Phänomene. Einige von ihnen sind aufgelistet:
- Schulungenthalpien für instabile Verbindungen oder Vermittler, wie wir es normalerweise in der organischen Chemie haben.
-Enthalpien von Phasenübergängen in der Untersuchung kristalliner Feststoffe.
Kann Ihnen dienen: Chemische Verbindung-Enthalpien allotropischer Übergänge wie dem zwischen Graphit und Diamant.
Ebenso wird das Hess -Gesetz verwendet, um die retikuläre Energie eines Feststoffs und die elektronischen Affinitäten einiger Atome zu bestimmen.
Beispiele: gelöste Übungen
- Beispiel 1
Berechnen Sie den ΔHrxn der folgenden Reaktion:
2HCl (g) + f2(g) → 2HF (l) + cl2(G)
Wenn Sie die folgenden Reaktionen und ihre jeweiligen Enthalpien haben:
4HCl (g) + oder2(g) → 2H2Oder (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2h2(g) + 1/2f2(g) → HF (L) (ΔH = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → h2Oder (l) (ΔH = -285.8 kJ/mol)
Gleichungen Ordnung
Zu Beginn müssen wir die Reaktionen so hinzufügen, dass HCL und F2 sind auf der linken Seite und HF und CL2, Auf der rechten Seite. Aber wichtiger ist, es bemerkt, dass so viel h2 als h2Oder nicht in der Zinsgleichung sind. Daher müssen wir sie in der Summe stornieren und die stöchiometrischen Koeffizienten durch Multiplikationen übereinstimmen:
2HCl (g) + 1/22(g) → h2Oder (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Diese Gleichung wurde mit 1/2 mit 2HCl anstelle von 4HCl multipliziert
H2(g) + f2(g) → 2HF (l) (ΔH = -600.0 kJ/mol) * (2)
Diese Gleichung multipliziert mit 2, um f zu haben2 und Nr. 1/2f2
H2Oder (l) → h2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
In der Zwischenzeit multiplizierte letztere mit -1, um es "zu drehen". Daher haben wir die geordneten Gleichungen und sind bereit hinzuzufügen.
Summe der Gleichungen
Alles hinzuzufügen gibt uns:
2HCl (g) + 1/22(g) → h2Oder (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2(g) + f2(g) → 2HF (l) ΔH = -1200.0 kJ/mol)
H2Oder (l) → h2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2HCl (g) + f2(g) → 2HF (l) +cl2(G)
Beachten Sie, dass Begriffe 1/22, H2Oder und h2 Sie werden abgesagt, weil sie auf beiden Seiten des Pfeils sind. Enthalpien werden ebenfalls hinzugefügt und geben:
ΔHrx = 285.8 kJ/mol + (-101).2 kJ/mol) + (-1200.0 kJ/mol)
Dieser Ausdruck ist der gleiche wie der Anfang:
ΔH = ΔH1 + ΔH2 + ΔH3
Und so haben wir, dass ΔHrx gleich ist:
ΔHrx = -1015.4 kJ/mol
- Beispiel 2
In diesem Beispiel ist zu erkennen, dass die Enthalpien der alternativen Reaktionen den Enthalpien der Bildung von Interessenverbindungen entsprechen.
Es ist erwünscht, ΔHrxn für die nächste Zersetzungsreaktion zu bestimmen:
2SO3(g) → 2so2(g) + oder2(G)
Und die Trainingsenthalpien der SO -Verbindungen werden zur Hand gezählt3 Und so2:
S (s) + o2(g) → so2(g) (ΔH = -296.8 kJ/mol)
Kann Ihnen dienen: Isopreno: Struktur, Eigenschaften, AnwendungenS (s) + 3/2o2(g) → so3(g) (ΔH = -395.6 kJ/mol)
Gleichungen Ordnung
Diese Übung wird auf die gleiche Weise wie das vorherige Beispiel gelöst. Es sollte so sein3 Seien Sie recht und multiplizieren Sie mit 2. Dafür müssen wir die SO -Formationsgleichung "drehen"3 Multiplizieren Sie es mit -1 und multiplizieren Sie es mit 2:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
Die so Formationsgleichung2 Wir multiplizieren es auch mit 2:
2s (s) + 2nd2(g) → 2so2(g) (ΔH = -296.8 kJ/mol) * (2)
Summe der Gleichungen
Jetzt werden die Gleichungen hinzugefügt:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ/mol)
2s (s) + 2nd2(g) → 2so2(g) (ΔH = -593.6 kJ/mol)
2SO3(g) → 2so2(g) + oder2(G)
Beachten Sie, dass der Begriff 2S beseitigt wird, weil er sich auf beiden Seiten des Pfeils befindet. Auch 32 2o ist abgezogen2 ein o geben2. Die Summe der Enthalpien und damit der Wert von ΔHrxn ist:
ΔH = ΔHrxn = 791.2 kJ/mol + (-593).6 kJ/mol)
= 197.6 kJ/mol
Wie jede Zersetzungsreaktion ist es endotherm, so dass seine Enthalpie positiv ist.
Alternative Methode
Es gibt eine Methode, um dasselbe Ergebnis direkter und einfacherer Weise zu erreichen. Dies wurde in einem früheren Abschnitt erwähnt.
2SO3(g) → 2so2(g) + oder2(G)
Um das ΔHrxn dieser Reaktion zu bestimmen, müssen wir ΔHºF (Reagenzien) und ΔHºF (Produkte) berechnen. Das ΔHºf (also3) entspricht -395.6 kJ/mol, während das ΔHºF (also2) entspricht -296.8 kJ/mol. Das ΔHºf (oder2) ist gleich 0, da elementarer Sauerstoff als Molekül von O existiert2 und nicht als Atome oder frei.
Also haben wir:
ΔHrxn = ΔHºF (Produkte) - ΔHºf (Reagenzien)
= [ΔHºf (also2) + ΔHºF (oder2)] - ΔHºf (so3)
= ΔHºF (so2) - ΔHºf (so3)
Wir müssen jedoch beide Trainingsenthalpien mit 2 multiplizieren, um den stöchiometrischen Koeffizienten in Bezug auf die chemische Gleichung zu entsprechen:
ΔHrxn = 2 & Dgr; HºF (also2) - 2δHºF (so3)
Und berechnen wir:
ΔHrxn = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
In der Tat wird es normalerweise vorgezogen, alle Übungen zu lösen, in denen das Hessgesetz angewendet wird.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Hessgesetz. Abgerufen von: in.Wikipedia.Org
- Cohen Shelly. (18. Mai 2020). Hessgesetz. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org
- Clark Jim. (2010). Hessgesetz und Enthalpie ändern Berechnungen. Erholt von: Chemguide.CO.Vereinigtes Königreich
- Helmestine, Anne Marie, ph.D. (11. Februar 2020). Hessgesetzdefinition. Erholt von: thoughtco.com
- Foist Laura. (2020). Hessgesetz: Definition, Formel und Beispiel. Lernen. Erholt von: Studium.com
- Quimitube. (2014). Theorie 14 Thermochemie: Berechnung der Enthalpie einer Reaktion durch Hessgesetz. Erholt von: Quimitube.com
- « Spannungstest, wie es gemacht wird, Eigenschaften, Beispiele
- Kompressionstest, wie es ausgeführt wird, Eigenschaften, Beispiele »

