Gesetz von mehreren Ausmaßen
- 3574
- 1104
- Tizian Liebich
Was ist das Gesetz mehrerer Ausmaße?
Der Gesetz von mehreren Ausmaßen Es wird festgelegt, dass der Anteil der Massen, mit denen einer von ihnen mit einer festen Masse des anderen kombiniert wird.
Die Gesetzesaussage mag komplex erscheinen, wenn Sie kein Beispiel zur Hand haben. Betrachten Sie daher einige Oreos -Kekse, die aus zwei Schokoladendeckeln und einem Streifen zuckerhaltiger Creme bestehen: T2C (t = Deckel und c = Creme). Wenn wir einen robusteren Oreo -Keks erfinden wollten, würden wir einen weiteren Sahne -Streifen hinzufügen, um Doppelcreme zu haben (t2C2 oder tc).
 In Desserts, wie z. B. Oreos Cookies. Quelle: Brokensphere, CC BY-SA 3.0 https: // creativecommons.Org/lizenzen/by-sa/3.0 über Wikimedia Commons
In Desserts, wie z. B. Oreos Cookies. Quelle: Brokensphere, CC BY-SA 3.0 https: // creativecommons.Org/lizenzen/by-sa/3.0 über Wikimedia Commons Wir könnten auch noch einen hinzufügen, damit der Keks dreimal mehr Creme hat als ein herkömmlicher Keks (t2C3). Was ist, wenn wir einen weiteren Schokoladendeckel in die Mitte der weißen Streifen legen (t3C2)? Die Optionen sind unbegrenzt; Aber wir fügen immer einen Deckel oder eine Creme -Einheit hinzu. Wir denken nicht an eine Hälfte des Deckels (1/2 T) oder an ein Fünftel Creme (1/5 c), weil es unangemessen wäre.
Ebenso wie es mit den chemischen Elementen passiert: Ihre Atome teilen sich nicht zu Verbindungen. Daher sind die Massen von T oder C unter ihren Verbindungen "immer" eine einfache Beziehung.
Erläuterung
Proportionen
Das Gesetz mehrerer Ausmaße, zusammen mit dem Gesetz der definierten Ausmaße, ging der Stöchiometrie und den ersten chemischen Formeln voraus. Vergessen wir die Kekse, aber halten wir ihre Symbole: T und C. Durch Experimente wird festgestellt, dass Elemente T und C mehrere Verbindungen bilden: T2C, TC und t2C3.
Vor den chemischen Formeln war es unmöglich, sofort zu wissen. Musste sie zuerst bestimmen. In einer Verbindung wurde festgestellt, dass sich die Masse von T auf die von C verdoppelte; Zu sagen, 2 Gramm T werden mit 1 Gramm C kombiniert.
Kann Ihnen dienen: Kapazität: Einheiten, Formeln, Berechnung, BeispieleDann mussten in der anderen Verbindung die Massen von T und C übereinstimmen: 2 Gramm T werden jetzt mit 2 Gramm C kombiniert. Hier stellt sich die Frage: Was ist, wenn T und C noch eine andere Verbindung bilden können? Wenn ja, würde es sicherlich mit 2 Gramm T gebildet, aber diesmal würden sie mit 3 Gramm C (1 Gramm + 1 Gramm + 1 Gramm) kombiniert.
Einfache Massenbeziehungen
Die Anteile der Massen, mit denen T und C reagieren, ermöglichen es, ihre chemischen Formeln festzulegen: T2C (2 Gramm T: 1 Gramm c), TC (2 Gramm T: 2 Gramm c) und t2C3 (2 Gramm T: 3 Gramm c). Wenn wir die Beziehungen der T- oder C -Massen in diesen Verbindungen vergleichen wollen, ist es notwendig, dass eine seiner Massen konstant bleibt; In diesem Fall das von T: 2 Gramm.
Daher bestimmen wir die Anteile der Masse von C in diesen drei Verbindungen:
- T2C: 1 Gramm C/2 Gramm t
- TC: 2 Gramm C/2 Gramm t
- T2C3: 3 Gramm C/2 Gramm t
Wir werden eine Beziehung für die Masse von C gleich 1: 2: 3 haben. Das heißt, es gibt 2 -mal mehr C in TC als in t2C und dreimal mehr c in t2C3 als in t2C. Wie zu sehen ist, sind 1: 2: 3 kleine ganze Zahlen (sie überschreiten das Dutzend nicht einmal).
Beispiele für das Gesetz mehrerer Ausmaße
Für die folgenden Beispiele werden dieselben früheren Schritte angewendet, aber wir werden die Molmassen der jeweiligen Elemente berücksichtigen, unter der Annahme eines Mol der Verbindung.
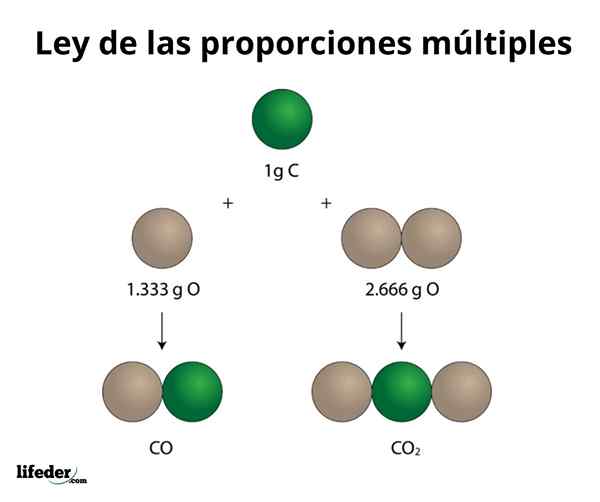
KOKOSNUSS2

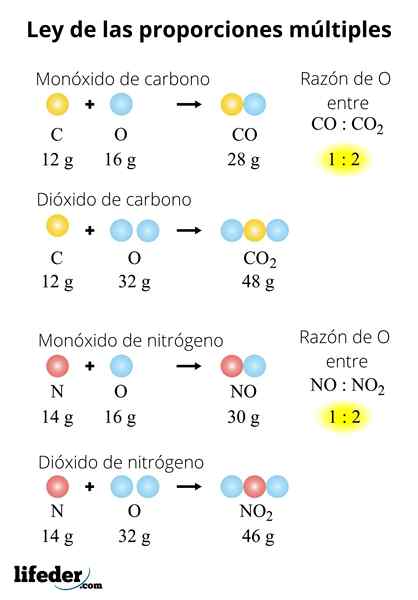
Dieses Beispiel erklärt auf einfache Weise, wie das Gesetz mehrerer Proportionen funktioniert. Im CO (Kohlenmonoxid) gibt es 1.333 Gramm Sauerstoff für jedes Gramm Kohlenstoff. In Kohlendioxid (CO₂) gibt es 2.666 Gramm Sauerstoff für jedes Gramm Kohlenstoff. Daher beträgt der Sauerstoffanteil in beiden Verbindungen 1: 2, eine kleine Ganzzahlzahl.
H2OH2ENTWEDER2
Das Gesetz mit mehreren Proportionen gilt für das H -Paar h2OH2ENTWEDER2.
Können Ihnen dienen: 30 Beispiele für chemische SuspensionenIn einem Mol von h2Oder 2 Gramm Wasserstoff werden mit 16 Gramm Sauerstoff kombiniert. Inzwischen in einem Mol von h2ENTWEDER2, 2 Gramm Wasserstoff werden mit 32 Gramm Sauerstoff kombiniert. Um zu überprüfen, ob dieses Gesetz erfüllt ist, müssen wir die gleiche Masse für eines der Elemente in beiden Verbindungen festlegen. Diese Zeit ist Wasserstoff: 2 Gramm.
Massenproportionen für h2Oder und h2ENTWEDER2 Sind:
- H2O: 16 Gramm oder/2 Gramm h
- H2ENTWEDER2: 32 Gramm oder/2 Gramm h
Das Verhältnis der Masse von O beträgt 16:32. Wir können es jedoch vereinfachen, indem wir durch 16 dividieren und 1: 2 bleiben. Auch hier besteht die endgültige Beziehung aus kleinen ganzen Zahlen.
SW2-SW3
In einem Mol von so2, 32 Gramm Schwefel werden mit 32 Gramm Sauerstoff kombiniert. Inzwischen in einem Mol von so3, 32 Gramm Schwefel werden mit 48 Gramm Sauerstoff kombiniert. Die Schwefelmasse ist für beide Verbindungen gleich, sodass wir Sauerstoffanteile direkt vergleichen können:
- SW2: 32 Gramm oder
- SW3: 48 Gramm oder
Das Verhältnis der Sauerstoffmasse zwischen beiden Verbindungen entspricht 32:48 oder 1: 1.5. Aber waren nicht da, dass es ganze Zahlen geben sollte? Beziehung 1: 1.5 (1/1.5) Es kann auch als 2: 3 (0) geschrieben werden.6), und wieder haben wir kleine ganze Zahlen: 2 und 3.
Beachten Sie, dass wir die Beziehung auch als 48:32 oder 1 geschrieben haben können.5: 1, das Ergebnis 3: 2. Das Gesetz ändert sich nicht, nur die Auslegung der Beziehung: Es gibt 1.5 oder 3/2 -mal mehr Sauerstoff im SO3 das im SO2; Das ist dasselbe zu sagen, dass es 2/3 oder 0 gibt.6 -mal weniger Sauerstoff im SO2 das im SO3.
Nein nein2-N2AN2ENTWEDER3-N2ENTWEDER5
Das Gesetz kann auch für eine Reihe von Verbindungen angewendet werden. Stickstoffoxide in Betracht ziehen: nicht nicht2-N2AN2ENTWEDER3-N2ENTWEDER5. Um dieses Gesetz in ihnen zu bewerten, müssen wir eine Masse von Stickstoff festlegen: 28 Gramm. Weil? Weil nein und nein2 Sie haben ein Stickstoffatom weniger als die anderen Oxide:
- 2 (Nein): 28 Gramm N/32 Gramm oder
- 2 (Nr2): 28 Gramm N/64 Gramm oder
- N2O: 28 Gramm N/ 16 Gramm oder
- N2ENTWEDER3: 28 Gramm n/ 48 Gramm oder
- N2ENTWEDER5: 28 Gramm n/ 80 Gramm oder
Vergessen wir Stickstoff und konzentrieren uns auf die Gramm des Sauerstoffs:
- 2 (Nein): 32 Gramm oder
- 2 (Nr2): 64 Gramm oder
- N2O: 16 Gramm oder
- N2ENTWEDER3: 48 Gramm oder
- N2ENTWEDER5: 80 Gramm oder
Das Verhältnis der Massen von oder gleich 32: 64: 16: 48: 80 ist. Um es zu vereinfachen, teilen wir alle seine Zahlen unter den kleinsten, die 16, die als 2: 4: 1: 3: 5 sind.
Das heißt, es gibt: 2 -mal mehr Sauerstoff im Nr. Als in der n2Oder 4 -mal mehr Sauerstoff in der Nein2 das in der n2Oder 3 -mal mehr Sauerstoff im n2ENTWEDER3 das in der n2Oder 5 -mal mehr Sauerstoff in der n2ENTWEDER5 das in der n2ENTWEDER. Auch hier haben wir kleine ganze Zahlen im Bereich von 1 bis 5.
Einschränkungen
Das Gesetz mehrerer Ausmaße wird nicht immer erfüllt. Zum Beispiel sind die Molmassen oder Atomgewichte der Elemente keine ganze Zahlen, sondern haben viele Dezimalstellen. Dies verändert die berechneten Beziehungen vollständig, die nicht mehr einfach sind.
Ebenso wird das Gesetz für schwere Verbindungen wie einige Kohlenwasserstoffe nicht erfüllt. Zum Beispiel das Unercano, CelfH24, hat 1.0083 oder 121/120 -mal mehr Wasserstoff als der Dekan, C10H22, deren Beziehung aus 121 und 120 besteht, die das Dutzend überschreiten; Sie sind keine kleinen ganzen Zahlen.
Und schließlich scheitert das Gesetz mit nicht -motiametrischen Verbindungen, wie bei vielen Oxiden und Sulfiden.
Abschluss
Das Gesetz mit mehreren Verhältnissen besagt, dass, wenn zwei Elemente mehr als eine Verbindung bilden, die verschiedenen Massen eines Elements, die sich mit der gleichen Masse des anderen Elements verbinden.
Verweise
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8. Aufl.). Cengage Lernen.
- Wikipedia. (2020). Gesetz von mehreren Ausmaßen. Abgerufen von: in.Wikipedia.Org
- Die Herausgeber von Enyclopaedia Britannica. (2020). Gesetz von mehreren Ausmaßen. Erholt von: Britannica.com
- Chemistrygod. (4. Juni 2019). Gesetz von mehreren Proportionen durch Dalton. Erholt von: Chemistrygod.com
- Garcia Nissa. (2020). Gesetz von mehreren Proportionen: Definition & Beispiel. Lernen. Erholt von: Studium.com

