Ritchter-Wenzel-Gesetz Was ist Geschichten, Aussagen, Beispiele
- 4948
- 1410
- Lewis Holzner
Der Ritchter-Wenzel-Gesetz oder der gegenseitigen Anteile ist einer, das feststellt. Es ist eines der Gesetze der Stöchiometrie zusammen mit dem Gesetz von Lavoissier (Gesetz der Massenschutz); das Proustgesetz (Gesetz der definierten Ausmaße); und Daltons Gesetz (Gesetz mehrerer Ausmaße).
Ritcher hat sein Gesetz 1792 in einem Buch ausgesprochen, das die Grundlagen der Stoichiometrie definierte, basierend auf den Forschungsarbeiten von Carl F Wenzel, der 1777 die erste Äquivalenztabelle für Säuren und Basen veröffentlichte.
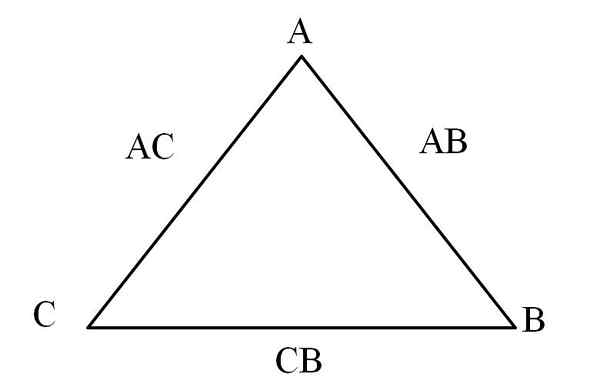
 Gegenseitigkeitsdreieck. Quelle: Gabriel Bolívar
Gegenseitigkeitsdreieck. Quelle: Gabriel Bolívar Eine einfache Möglichkeit, dies zu visualisieren, ist durch ein "Gegenseitigkeitsdreieck" (überlegenes Bild). Wenn die Massen von A, C und B bekannt sind, die gemischt sind, um die AC- und AB -Verbindungen zu bilden, kann festgestellt werden.
In den Verbindungen AC und AB ist das Element A in beiden vorhanden.
[TOC]
Geschichte und Allgemeinheiten des Gesetzes des gegenseitigen Ausmaßes
Richter stellte fest, dass der Gewichtsanteil der in einer chemischen Reaktion verbrauchten Verbindungen immer gleich ist.
In dieser Hinsicht stellte Ritcher fest, dass beispielsweise 615 Teile nach Gewicht von Magnesia (MGO) erforderlich sind, um 1000 Teile nach Gewicht von Schwefelsäure zu neutralisieren.
Zwischen 1792 und 1794 veröffentlichte Ritcher eine Zusammenfassung von drei Bänden, die seine Arbeiten über das Gesetz definierter Ausmaße enthielten. Die Zusammenfassung versuchte die Stöchiometrie und definierte sie als Kunst chemischer Messungen.
Kann Ihnen dienen: feine Schichtchromatographie: Eigenschaften, wofür es istDarüber hinaus befasst sich die Stöchiometrie mit den Gesetzen, nach denen Substanzen Verbindungen bilden werden. Richters Forschungsarbeiten wurden jedoch für die mathematische Behandlung kritisiert, die er verwendete, und stellte fest, dass er seine Ergebnisse angepasst hat.
Im Jahr 1802 veröffentlichte Ernst Gottfried Fischer die erste Tabelle chemischer Äquivalente, die Schwefelsäure mit der Abbildung von 1000 verwendete; Ähnlich dem von Richter gefundenen Wert für die Neutralisation von Schwefelsäure durch Magnesia.
Es wurde jedoch darauf hingewiesen, dass Richter eine Tabelle mit Kombinationspesos errichtete, die den Anteil angibt. Zum Beispiel wird angegeben, dass 859 NaOH -Teile 712 Teile HNO neutralisieren3.
Aussagen und Konsequenzen
Die Erklärung des Gesetzes von Richter-Wenzel lautet wie folgt: Die Massen von zwei verschiedenen Elementen, die mit dem gleichen Betrag eines dritten Elements kombiniert sind, behalten die gleiche Beziehung wie die Massen dieser Elemente, wenn sie miteinander kombiniert werden.
Dieses Gesetz ermöglichte die Festlegung des äquivalenten Gewichts oder das Gewichts-Rasur-Gramm, wie die Menge eines Elements oder einer Verbindung, die mit einer festen Menge einer Referenzsubstanz reagiert.
Richter, die als Kombinationsgewichte bezeichnet werden, die mit den Gewichten der Elemente zusammenhängen, die mit jedem Gramm Wasserstoff kombiniert wurden. Die relativen Kombinationsgewichte von Richter entsprechen dem, was derzeit als äquivalentes Gewicht der Elemente oder Verbindungen bezeichnet wird.
In Übereinstimmung mit dem vorherigen Ansatz kann das Gesetz von Richter-Wenzel wie folgt angegeben werden:
Die Kombinationsgewichte verschiedener Elemente, die mit einem bestimmten Gewicht eines bestimmten Elements kombiniert sind.
Es kann Ihnen dienen: Methoden zur Trennung heterogener GemischeBeispiele
Calciumchlorid
In Calciumoxid (CAO) werden 40 g Calcium mit 16 g Sauerstoff (O) kombiniert. Inzwischen in hypochlorous Oxid (CL)2O) 71 g Chlor werden mit 16 g Sauerstoff kombiniert. Welche Verbindung würde Kalzium bilden, wenn sie mit Chlor kombiniert werden?
Unter Verwendung des Gegenseitigkeitsdreiecks ist Sauerstoff das gemeinsame Element für die beiden Verbindungen. Die Massenanteile der beiden sauerstoffhaltigen Verbindungen werden zuerst bestimmt:
40g ca/16 go = 5g ca/2g oder
71g cl/16g oder
Und nun die beiden Massenproportionen von CAO und CL aufzuteilen2Oder wir werden:
(5g ca/2g o)/(71 g cl/16g o) = 80 g Ca/142g Cl = 40 g Ca/71G Cl
Beachten Sie, dass das Gesetz der Massenanteile erfüllt ist: 40 g Calcium reagieren mit 71 g Chlor.
Schwefeloxide
Sauerstoff und Schwefel reagieren mit Kupfer, um Kupfer (CUO) bzw. Kupfersulfid (CUS) zu ergeben. Wie viel Schwefel würde mit Sauerstoff reagieren?
Im Kupferoxid werden 63,5 g Kupfer mit 16 g Sauerstoff kombiniert. In Kupfersulfid werden 63,5 g Kupfer mit 32 g Schwefel verbunden. Teilen Sie die Massenproportionen, die wir haben:
(63,5 g cu/16g o)/(63,5 g Cu/32 g s) = 2032 g
Massenanteil 2: 1 ist ein Vielfaches von 4 (63,5/16), was zeigt, dass das Gesetz des Richters erfüllt ist. Mit diesem Verhältnis wird das SO -Schwefelmonoxid (32 g Schwefel mit 16 g Sauerstoff reagiert) erhalten.
Wenn dieser Anteil durch zwei geteilt wird, wird es 1: 1 geben. Auch hier ist es jetzt 4 oder 2, und deshalb ist es das SO2, Schwefeldioxid (32 g Schwefel reagiert mit 32 g Sauerstoff).
Kann Ihnen dienen: Fucosa: Eigenschaften, Struktur, FunktionenSulfid und Eisenoxid
Eisensulfid (FES) wird reagiert, bei dem 32 g Schwefel mit 56 g Eisen kombiniert werden, mit Eisen (hässlich) Oxid, bei dem 16 g Sauerstoff mit 56 g Eisen kombiniert werden. Dieses Element dient als Referenz.
In Fes und hässlichen reagierenden Verbindungen werden Schwefel (S) und Sauerstoff (O) in Bezug auf Eisen (Glauben) in Anlage 2: 1 gefunden. In schwefelförmigem Oxid (SO) 32 g Schwefel werden mit 16 g Sauerstoff kombiniert, so dass Schwefel und Sauerstoff in Anlage 2: 1 gefunden werden.
Dies zeigt an, dass das Gesetz der gegenseitigen Ausmaße oder des Gesetzes des Richter erfüllt ist.
Der Anteil zwischen Schwefel und Sauerstoff in Schwefeloxid (2: 1) könnte beispielsweise verwendet werden, um zu berechnen, wie viel Sauerstoff mit 15 g Schwefel reagiert.
o Sauerstoff g = (15 g s) ∙ (1 g O/2 g s) = 7,5 g
Verweise
- Gesetz des gegenseitigen Anteils: Definition & Beispiel. Lernen. Erholt von: Studium.com
- Gesetz der gegenseitigen Ausmaße. Chemistry Librettexts. Erholt von: Chem.Librettexts.Org

