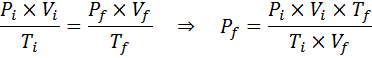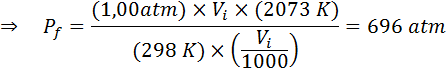Allgemeines Gasengesetz

- 4286
- 46
- Joe Hartwig
Was ist das allgemeine Gasgesetz??
Der Allgemeines Gasengesetz, Manchmal auch als kombiniertes Gesetz von Gasen bezeichnet, ist es die Kombination aus Boyle's Laws Charles und Gay-Lussac. Es ist ein Gesetz, das die Beziehung zwischen dem Druck, der Temperatur und dem Volumen einer festen Menge eines idealen Gases beschreibt.
In der Aussage dieses Gesetzes heißt es:
„Wenn die Anzahl der Mol eines Gases konstant ist, bleibt die Beziehung zwischen dem Druck-Volumen und dem Temperaturprodukt konstant."
In mathematischer Form wird das allgemeine Gasengesetz wie folgt ausgedrückt:
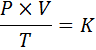
Wobei P den Druck des Gases, v sein Volumen, T seine absolute Temperatur und k darstellt.
Alternative Formen des allgemeinen Gasgesetzes
Als Verhältnismäßigkeitsgesetz
Ein alternativer Weg, um das allgemeine Gesetz der Gase auszusprechen, ist in Form eines Gesetzes der Verhältnismäßigkeit:
"Für eine feste Menge eines Gases ist das Produkt des Drucks und seines Volumens direkt proportional zur Temperatur".
Das bedeutet, dass:
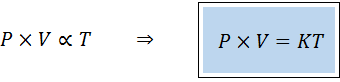
Dies entspricht der Multiplikation beider Mitglieder der ersten Gleichung mit Temperatur.
Beziehung zwischen dem anfänglichen und dem endgültigen Zustand
Wie die Gesetze von Boyle, Charles und Gay-Lussac kann das allgemeine Gasgesetz als eine Beziehung zwischen dem Anfangszustand und dem endgültigen Zustand eines Gas ausgedrückt werden, das sich einer Staatsänderung unterzieht.
Im Gegensatz zu den vorherigen Gesetzen ist es nicht notwendig, dass keine der drei Variablen konstant bleibt, nur die Anzahl der Maulwürfe. Das heißt, dass das PXV/T -Verhältnis im Anfangszustand gleich sein wird, Yo, und im letzten Zustand, F. Mit anderen Worten, das allgemeine Gasgesetz kann auch mathematisch ausgedrückt werden als:
Es kann Ihnen dienen: Píchric Acid: Was ist, Struktur, Synthese, Eigenschaften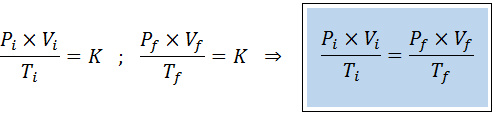
Ableitung der Formel des allgemeinen Gasgesetzes
Wie oben erwähnt, stammt das allgemeine Gasgesetz aus der Kombination von Boyle, Charles und Gay-Lussacs Gesetzen. Diese Gesetze werden nachstehend vorgestellt:
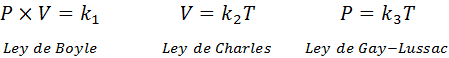
Wenn wir aus jedem dieser Gesetze die Konstante klären k, Und dann multiplizieren wir sie miteinander, wir bekommen:
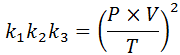
Wenn Sie nun die Quadratwurzel in beiden Mitgliedern nehmen, wird das allgemeine Gasgesetz erhalten:
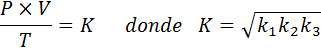
Das allgemeine Gesetz der Gase vs. Das Gesetz der idealen Gase
Das allgemeine Gasesgesetz mit dem idealen Gasengesetz sollte nicht verwirrt werden. Obwohl das allgemeine Gasgesetz zwei sehr ähnliche und auch eng verwandte Gesetze ist, kombiniert es nur die Gesetze von Boyle, Charles und Gay-Lussac.
Das ideale Gasesgesetz fügt das Avogadro -Prinzip hinzu, nach dem "Gleiche Volumina verschiedener Gase, die unter den gleichen Temperatur- und Druckbedingungen gemessen wurden, enthalten die gleiche Anzahl von Partikeln. “.
Infolgedessen ermöglicht das Gesetz von idealem Gas zusätzlich zu Temperatur, Volumen und Druck auch diese Variablen mit der Anzahl der Partikel oder der Mol eines Gases, sodass es die Zustandsgleichung des Status des Status darstellt Ideale Gase.
In den folgenden Gleichungen kann der Unterschied zwischen diesen beiden Gesetzen leichter beobachtet werden:

Beachten Sie, dass der Hauptunterschied zwischen beiden Gesetzen besteht, dass das ideale GASE -Gesetz umfasst N, Dies repräsentiert die Anzahl der Maulwürfe und auch anstelle der Konstante K, hat Die Konstante r, die die Konstante der idealen Gase ist.
Kann Ihnen dienen: TerpenosWir könnten sagen, dass das ideale Gasesgesetz allgemeiner ist als das allgemeine Gasgesetz. Andererseits erfordert die Anwendung des allgemeinen Gasgesetzes, dass die Gasmenge konstant bleibt.
Beispiele für die Anwendung des allgemeinen Gasgesetzes
Im Folgenden finden Sie einige Beispiele für typische Probleme, bei denen das allgemeine Gasgesetz angewendet werden kann:
Beispiel 1: Eine Unterwasserluftblase
Angenommen, ein Taucher, der in einer Tiefe von 20 m unter Wasser liegt, wobei der Druck 3,00 atm beträgt und die Temperatur 15 ° C beträgt und einen Luftatte und eine der Blasen ein anfängliches Volumen von 100 cm hat3.
Bestimmen Sie das Volumen der Luftblase, wenn sie die Oberfläche an Standardtemperatur- und Druckbedingungen erreicht, vorausgesetzt, die Luftmenge innerhalb der Blase ändert sich nicht, wenn sie steigt.
Lösung
Zunächst müssen wir alle Daten aus der Anweisung extrahieren. Es wird davon ausgegangen. Es ist auch notwendig, die Temperaturen bei absoluter Temperatur umzuwandeln:

Da das Problem angibt, dass sich die Menge an Gas (die Luft) nicht ändert, können wir das allgemeine Gasgesetz anwenden, aus dem wir das endgültige Volumen löschen können:
Kann Ihnen dienen: Rodio: Geschichte, Eigenschaften, Struktur, Verwendungszwecke, Risiko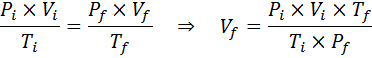
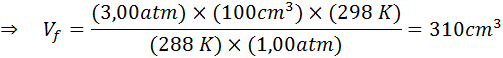
Daher erreicht die Luftblase ein Volumen von 310 cm3 Beim Erreichen der Oberfläche.
Beispiel 2: Hochdruck
Wie viel wird der Druck eines idealen Gases bei einer Umgebungstemperatur von 25 ° C und einem Druck von 1,00 atm und dem Tausendstel seines Volumens gleichzeitig bis zu 1800 ° C in einem versiegelten Behälter komprimieren?
Lösung
Nach wie vor extrahieren wir die Daten:

Wie es heißt, dass das Verfahren in einem versiegelten Behälter durchgeführt wird, ändert sich die Menge an Gas nicht, sodass das allgemeine Gasgesetz angewendet werden kann: