Stöchiometrische Gesetze

- 4015
- 636
- Nick Laurén
Was sind stöchiometrische Gesetze??
Stöchiometrische Gesetze beschreiben die Zusammensetzung verschiedener Substanzen, die auf (Massen-) Beziehungen zwischen jeder an der Reaktion beteiligten Spezies basieren.
Alle vorhandenen Materie werden durch die Kombination in verschiedenen Anteilen der verschiedenen chemischen Elemente gebildet, aus denen die Periodenzüchter besteht. Diese Gewerkschaften unterliegen bestimmten Kombinationsgesetzen, die als Stöchiometriegesetze oder Chemiegewichte bekannt sind.

Diese Prinzipien sind ein grundlegender Bestandteil der quantitativen Chemie und sind für den Gleichgewichtsbilanz und für solche wichtigen Operationen, wie z.
Sie sind im chemischen Bereich der Wissenschaft "die vier Gesetze" weithin bekannt: Recht der Massenschutz, Gesetz der definierten Ausmaße, Recht der Mehrfachverhältnisse und Recht der gegenseitigen Ausmaße.
Die 4 stöchiometrischen Gesetze
Wenn es erwünscht ist, die Art und Weise zu bestimmen, wie zwei Elemente durch eine chemische Reaktion kombiniert werden, sollten die vier nachstehenden Gesetze berücksichtigt werden.
Massenschutzgesetz (oder "Gesetz der Materie")
Dieses Gesetz basiert auf dem Prinzip, dass Materie nicht geschaffen oder zerstört werden kann, dh es kann nur verwandelt werden.
Dies bedeutet, dass für ein adiabatisches System (bei dem keine Massenübertragung oder Energie von oder in der Umgebung vorhanden ist) die Menge an gegenwärtiger Materie ständig rechtzeitig verbleiben.
Zum Beispiel wird bei der Bildung von Wasser aus Sauerstoff und gasförmiger Wasserstoff beobachtet, dass es vor und nach der Reaktion die gleiche Menge an Mol jedes Elements gibt, sodass die Gesamtmenge der Materie erhalten bleibt.
Kann Ihnen dienen: Valencia -Schicht2H2(g) + oder2(g) → 2H2Oder (l)
-
Übung:
P.- Zeigen, dass die vorherige Reaktion dem Gesetz der Erhaltung der Masse entspricht.
R.- Erstens gibt es die Molmassen der Reaktanten: H2= 2 g oder2= 32 g und h2O = 18 g.
Dann wird die Masse jedes Elements auf jeder Seite der Reaktion (ausgewogen) hinzugefügt, was sich ergibt: 2H2+ENTWEDER2 = (4+32) g = 36 g auf der Seite der Reaktanten und 2H2O = 36 g auf der Seite der Produkte. Somit wurde gezeigt, dass die Gleichung dem oben genannten Gesetz entspricht.
Gesetz der definierten Ausmaße (oder „Gesetz der ständigen Ausmaße“)
Es basiert darauf.
Das Beispiel des Wassers, dessen Zusammensetzung in seinem reinen Zustand immer 1 mol von o2 (32g) und 2 Mol von H2 (4g). Wenn der maximal gemeinsame Divisor angewendet wird, wird festgestellt, dass ein Mol von H reagiert2 für alle 8 Maulwürfe von oder2 Oder was ist gleich, sie kombinieren mit Vernunft 1: 8.
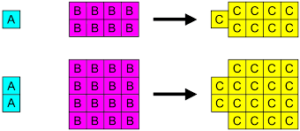
-
Übung:
P.- Es gibt einen Mol Hydrochlorsäure (HCL), und Sie möchten wissen, welcher Prozentsatz jeder seiner Komponenten ist.
R.- Es ist bekannt, dass der Grund für die Vereinigung dieser Elemente in dieser Art 1: 1 beträgt. Und die Molmasse der Verbindung beträgt ungefähr 36,45 g. Auf die gleiche Weise ist bekannt, dass die Molmasse von Chlor 35,45 g beträgt und der Wasserstoff 1 g beträgt.
Um die prozentuale Zusammensetzung jedes Elements zu berechnen, wird die Molmasse des Elements (multipliziert mit seiner Menge an Mol in einem Mol der Verbindung) zwischen der Masse der Verbindung geteilt und dieses Ergebnis multipliziert sich um einhundert.
Kann Ihnen dienen: Verflüssigung: Konzept, Gase, Böden und seismisch, SamenAlso: %H = [(1 × 1) g/36,45 g] x 100 = 2,74 %
Y %cl = [(1 × 35,45) g/36,45 g] x 100 = 97,26 %
Daraus wird geschlossen, dass die HCL in ihrem reinen Zustand immer durch 2,74% Wasserstoff und 97,26% Chlor gebildet wird, unabhängig davon, woher die HCL stammt.
Gesetz von mehreren Ausmaßen
Nach diesem Gesetz, wenn es eine Kombination zwischen zwei Elementen gibt, um mehr als eine Verbindung zu erzeugen, dann verbindet die Masse eines der Elemente eine unveränderliche Masse des anderen und behält eine Beziehung, die sich durch kleine Zahlen manifestiert.
Dioxid und Kohlenmonoxid werden als Beispiel angegeben, beispielsweise zwei Substanzen, die aus denselben Elementen bestehen, aber im Dioxid sind sie als o/c = 2: 1 verwandt (für jedes Atom von C gibt es zwei von o) und in der Monoxid seine Beziehung beträgt 1: 1.
-
Übung:
P.- Sie haben die fünf verschiedenen Oxide, die stabil sein können, um Sauerstoff und Stickstoff zu kombinieren (N2Oder nein, n2ENTWEDER3, N2ENTWEDER4 und n2ENTWEDER5).
R.- Es wird beobachtet, dass der Sauerstoff in jeder Verbindung zunimmt und dass mit einem festen Anteil an Stickstoff (28 g) ein Verhältnis von 16, 32 (16 × 2), 48 (16 × 3), 64 (16 × 4) vorliegt, ein Verhältnis von 16, 32 (16 × 2). und 80 (16 × 5) G Sauerstoff; Das heißt, es gibt einen einfachen Grund von 1, 2, 3, 4 und 5 Teilen.
Gesetz der gegenseitigen Ausmaße (oder "Gesetz von äquivalenten Ausmaßen")
Es basiert auf der Beziehung zwischen den Anteilen, in denen ein Element in verschiedenen Verbindungen mit unterschiedlichen Elementen kombiniert wird.
Mit anderen Worten, wenn eine Spezies A eine Spezies B verbindet, aber auch mit C kombiniert wird; Es muss sein, dass Elemente B und C verbunden sind. Die Massenbeziehung dieser entspricht den Massen, die jeweils mit einer festen Masse des Elements A beitragen.
-
Übung:
P.- Wenn Sie 12 g C und 64 g S haben, um CS zu bilden2, Außerdem gibt es 12 g C und 32 g O, um CO zu studieren2 und schließlich 10 g S und 10 g O, um so zu produzieren2. Wie kann das Prinzip der äquivalenten Anteile veranschaulicht werden??
Es kann Ihnen dienen: hypoklorische Säure (HCLO): Struktur, Eigenschaften, Verwendungen, SyntheseR.- Der Anteil der Schwefel- und Sauerstoffmassen in Kombination mit einem definierten Kohlenstoffteig beträgt 64:32, dh 2: 1. Dann beträgt der Anteil von Schwefel und Sauerstoff 10:10, wenn sie direkt anschließt oder was gleich ist, 1: 1. Die beiden Beziehungen sind also ein einfacher Vielfaches jeder Art.
Verweise
- Wikipedia. (S.F.). Stöchiometrie. Abgerufen von.Wikipedia.Org.
- Chang, R. (2007). Chemie, Neunte Ausgabe (McGraw-Hill).
- Jung, s. M., Vining, W. J., Tag, r., und Botch, b. (2017). (Allgemeine Chemie: Atome zuerst. Aus Büchern erholt.Google.CO.gehen.
- Szabadváry, f. (2016). Geschichte der analytischen Chemie: Internationale Reihe von Monographien in der analytischen Chemie. Aus Büchern erholt.Google.CO.gehen.
- Khanna, s. K., Verma, n. K., Und Kapila, b. (2006). Excel mit objektiven Fragen in der Chemie. Aus Büchern erholt.Google.CO.gehen.

