Die Funktionen und Typen
- 4164
- 583
- Lewis Holzner
Die Liasas Sie sind Enzyme, die am Schnitt oder die Zugabe von Gruppen in einer chemischen Verbindung teilnehmen. Das Prinzip dieser Reaktion basiert auf dem Schnitt von C-C-, C-O- oder C-N-Links. Folglich werden neue Doppelbindungen oder Ringstrukturen gebildet (Mahdi und Kelly, 2001).
Andererseits beteiligen sich Liasas an zellulären Prozessen wie dem Zyklus von Zitronensäure und organischer Synthese wie Cyanohydrinproduktion.
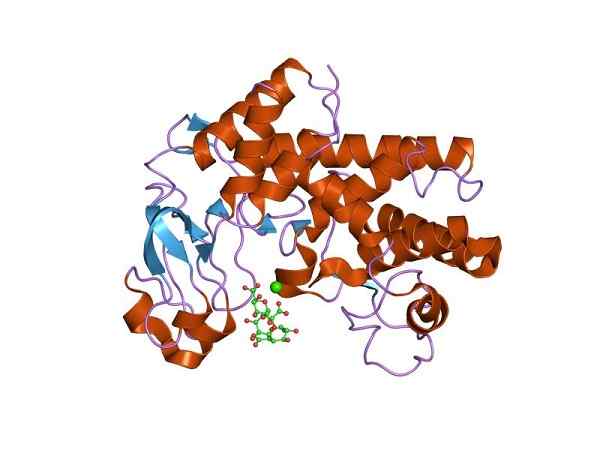
 Drei -dimensionale Struktur von Liasa -Polygalacturonsäure (Liasa Pektat). Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.org/lizenzen)] aus Wikimedia Commons.
Drei -dimensionale Struktur von Liasa -Polygalacturonsäure (Liasa Pektat). Von Jawahar Swaminathan und MSD -Mitarbeitern des Europäischen Bioinformatikinstituts [Public Domain (https: // CreativeCommons.org/lizenzen)] aus Wikimedia Commons. Diese Proteine unterscheiden sich von anderen Enzymen, da sie bestimmte besondere Details vorstellen. In gewissem Sinne der Reaktion wirken sie auf zwei Substrate, während sie in der entgegengesetzten Richtung nur ein Substrat betreffen.
In der Tat führt seine Wirkung zur Eliminierung eines Moleküls, das eine Doppelbindungsstruktur oder das Auftreten eines neuen Rings erzeugt. Insbesondere das Liasa -Polycalacturonsäure -Enzym (Liasa Pektat), das das Pektin bricht und einfache Einheiten von Galakturonic, Ramnosa und Dextrinsäure entsteht. Darüber hinaus ist es in einigen Pilzen und phytopathogenen Bakterien vorhanden.
[TOC]
Funktionen der Liasas
Liasas ist eine interessante Enzymgruppe, die viele Papiere im Leben unseres Planeten hat. Daher sind sie Protagonisten wichtiger Prozesse für das Leben von Organismen.
Das heißt, das Fehlen dieser Proteine induziert den Tod von Wesen. Wie auch immer, das Wissen über diese Proteine macht Spaß und schockierend. Andererseits lehrt es die Komplexität der uns umgebenden Prozesse.
Darüber hinaus variieren seine Funktionen je nach Art der Liasa. Folglich gibt es eine Vielzahl von Enzymen mit LIASA -Aktivität. So, dass sie in der Lage sind, Schnitte in den Verbindungen sehr variabler Moleküle vorzunehmen.
Lassen Sie uns auf der anderen Seite einige Beispiele für diese Proteine und die Funktionen sehen, die sie ausführen:
Kann Ihnen dienen: Herpetologie: Geschichte, Sammlungen, HerpetologefunktionPhospholipase C von Bacillus sp
Vermittelt diesem Körper die Möglichkeit, das Verdauungssystem einiger Insekten zu ändern. Daher bevorzugt es seine schnelle Multiplikation im gesamten Körper des Tieres.
Carboanhydrase
Kohlendioxid in Bicarbonat und Protonen umwandeln. In Gegenwart von Wasser hängt es mit der Aufrechterhaltung des Säure-Base-Gleichgewichts im Blut und in Geweben sowie mit der schnellen Eliminierung des Kohlendioxids zusammen.
Dieses Enzym in Pflanzen erhöht jedoch die Konzentration von Kohlendioxid in Chloroplasten, wodurch die Carboxylierung des Rubisco -Enzyms erhöht wird.
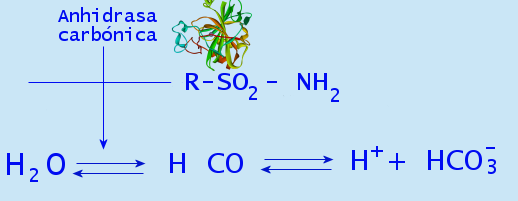
Reaktion durch carbonische Anhydrase katalysiert. Von Garciagerry [CC BY-SA 3.0 (http: // creativecommons.Org/lizenzen/by-sa/3.0/)] aus Wikimedia Commons.
Enolase
Konvertiert 2-phosphoglycerat in Phosphoenolpyruvat in Glykolyse. So können Sie in der Gluconeogenese die umgekehrte Reaktion durchführen. Offensichtlich versucht es, Glukose zu synthetisieren, wenn ein Defizit dieses Zuckers in den Zellen vorliegt.
Zusätzlich zu diesen klassischen Funktionen ist Enolase in Nervenzellen -Axonen vorhanden. Es ist auch ein Marker für neuronale Läsionen und andere Schäden des Nervensystems.
Carboxylase
Infolge seiner Wirkung beseitigt es Carboxylgruppen aus Pyruvsäure. Folglich macht es es Ethanol und Kohlendioxid.
Zerstöre in Hefen das CO2 der Zellen und studiere Ethanol. Diese Verbindung wirkt als Antibiotikum.
Phospholipase c
Es befindet sich in den Membranen der Tripanosomen und einer Vielzahl von Bakterien. Erzeugt den Proteinschnitt des in diesen Membranen vorhandenen GPI. In der Tat wurde es in festgestellt Trypanosoma Brucei.
Pepck
Es interveniert die Glukoneogenese, wandelt Oxalacetat in Fosphoenolpyruvat und Kohlendioxid um. Andererseits ermöglicht es bei Tieren Leber- oder Nierenzellen, Glukose aus anderen Metaboliten zu bilden.
Aldolase
Es übt seine Wirkung in der Glykolyse aus; Schneiden Sie die Fructose-1,6-BF in zwei Triosas, DHAP- und Glyceraldehyd 3-phosphat. Daher spielt dieses Enzym im Cytosol der meisten Organismen eine wichtige Rolle bei der Extraktion von Zuckerergie.
Es kann Ihnen dienen: Korallenriffe: Eigenschaften, Bildung, Typen, Flora, FaunaAndererseits ist die Bewertung der Blut- (oder Serum-) Aldolase ein Werkzeug, mit dem die beschädigten Strukturen in Organen wie Leber, Muskel, Niere oder Herz bestimmen können.
Liasa Miete
Es übt seine Wirkung auf ein Alkary-Mercury-Substrat und Wasserstoffionen aus, um ein Alkan- und Quecksilberionen zu produzieren.
Seine grundlegende biologische Aufgabe ist es, an toxischen Eliminierungsmechanismen teilzunehmen, da es organische Quecksilberverbindungen in Wirkstoffe umwandelt, die nicht schädlich sind.
Oxalomalat liasa
Insbesondere transformiert es 3-oxomalat in zwei Produkte: Oxoacetat und Glioxilat.
Es funktioniert im Krebszyklus, so dass Pilze, Protisten und Pflanzen Zucker aus Acetaten bilden, die aus dem Medium entnommen wurden.
Arten von Liasas
Innerhalb der Liasas -Gruppe gibt es mehrere Unterklassen:
Zieh Carbon-Kohlenstoff
Diese Enzyme schneiden Kohlenstoffkohlenstoffbindungen ab. Sie werden als folgende Typen eingestuft:
- Carboxy-Liasas: das fügen oder entfernen Cooh. Insbesondere entfernen sie Aminosäuregruppen des Alpha-Zo-Säure- und Beta-Ecoto-Sacid-Typs.
- Cho-liasas: Kondensieren Aldolgruppen im umgekehrten Sinne.
- Ox Liasas Säure: Sie schneiden die Säure 3-ROH oder umgekehrte Reaktionen.
Liasas cArbon-oXigen
Diese Enzyme brechen C-O-Links. Sie sind zwischen ihnen:
1) Hydrolysa, das Wasser beseitigt. Wie sie sind unter anderem Carbonat- oder De-Hydratasa Citrat, Fumarat Hydratasa.
2) Liasas, die Zuckeralkohol einnehmen. Heparin Liasa, Pectato Liasa, Glucuronan Liasa werden zusätzlich zu vielen anderen Enzymen gefunden (Alberheim 1962, Courtois 1997).
3) liasas, die ihre Wirkung auf Phosphatsubstrate ausüben und Phosphat entfernen.
Kohlenstoff-Stickstoff-Liases
Offensichtlich sind es Enzyme, die Kohlenstoff-Stickstoff-Gewerkschaften schneiden. Sie sind unterteilt in:
1) Liasas Ammonium, die Kohlenstoff-Stickstoffverbindungen brechen und NH3 bilden. Deren Aktion auf Aspartat, Treonin oder Histidin ist.
Kann Ihnen dienen: Chemotropismus2) Darüber hinaus gibt es Liasas, die C-N-Links zu Amidas oder Amidinen schneiden. Zum Beispiel Adenylosuccinat liasa.
3) Amino-Liasas, schneidet Kohlenstoff-Stickstoff-Gewerkschaften in Amingruppen ein. Auf diese Weise, dass die strenge Syntasa Sidine, Deacel ipecosido syntasa, in dieser Gruppe von Enzymen befindet.
Liasas Carbon-Azufre
Sie sind Enzyme, die Kohlenstoffbindungen schneiden. Zum Beispiel Liasa Cysin, Lactailliona liasa oder γ-LIASA-Methodin.
Liasas Carbon-Halogenuro
Erstens wurde diese Unterklasse ursprünglich auf der Grundlage des Enzyms zur Eliminierung von Salzsäure (HCl) aus 1,1,1-truso-22.2-Bis-Eeto (DDT) festgelegt.
Phosphor-Sauerstoff
Phospholipase C findet sich in dieser Kategorie von Liasas.
Zieh Carbon-Fosphor
Insbesondere üben sie ihre Wirkung auf Kohlenstoff-Phosphor-Gewerkschaften aus.
Verweise
- Mahdi, J.G., Kelly, d.R., 2001. Lyes. In: rehm, h.-J., Reed, g. (Hrsg.), Biotechnologie -Set. Wiley-vch Verlag GmbH, Weinheim, Deutschland, pp. 41-171.
- Palomeque p., Martínez m., VALDIVIA E. und Maqueda m. (1985). Vorläufige Untersuchungen der entomotoxischen Wirkung von Bacillus latrosporus vor der Larve. Schüssel. Servieren. Schädlinge, 11: 147-154.
- LaFrance-Vanasse, J.; Lefebvre, m.; Di lello, p.; Sygusch, j.; Omichinski, J. G. (2008). Kristallstrukturen der organomercurialen Lyase Merb in seiner freien und quecksilbergebundenen Formen in den Mechanismus des Methylquecksilberabbaus formen. JBC, 284 (2): 938-944.
- Kondrashov, Fyodor A; Koonin, Eugene V; Morgunov, Igor G; Finogenova, Tatiana V; Kondrashova, Marie N. (2006). Evolution von Glyxilatzyklusenzymen in Metazoa: Hinweise auf horizontale Mehrfachtransfers und Pseudogene Bildung. Biologie direkt, 1:31.
- Alberheim, p. und Killias, u. (1962). Studien zur Reinigung und Eigenschaften von Pektintranseliminase. Bogen. Biochem. Biophys. 97: 107-115.
- Courtois B, Courtois J (1997). Identifizierung von Glucuronan Lyase aus einem mutierten Stamm von Rhizobium meliliti. Int. J. Biol. Makromol. 21 (1-2): 3-9.

