Lipasa Caracateristic, Struktur, Typen, Funktionen
- 837
- 192
- Luca Holdt
Der Lipasas Sie bilden eine große Familie von Enzymen, die die Hydrolyse der in Substraten wie Triglyceriden, Phospholipiden, Cholesterinester und einigen Vitaminen vorhandenen Esterbindungen katalysieren können.
Sie sind praktisch in allen Königreichen des Lebens vorhanden, sowohl in Mikroorganismen als auch in Bakterien und Hefen, wie bei Pflanzen und Tieren; In jeder Art von Organismus haben diese Enzyme spezielle Eigenschaften und Eigenschaften, die sie voneinander unterscheiden.
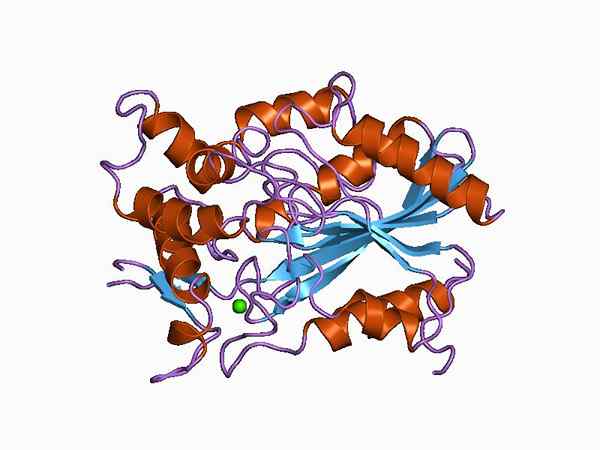
 Grafische Darstellung der molekularen Struktur einer Lipase (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons)
Grafische Darstellung der molekularen Struktur einer Lipase (Quelle: Jawahar Swaminathan und MSD -Mitarbeiter des Europäischen Bioinformatikinstituts [Public Domain] über Wikimedia Commons) Abhängig von der Art der Klassifizierung kann die Unterscheidung zwischen den "wahren" Lipasas durchgeführt werden, die auch als Lipas Triacylglycerin bekannt sind.
Der erste veröffentlichte Bericht über die Sequenz einer Enzymlipase war der von De Caro und Mitarbeitern im Jahr 1981, der die Triacilglycerol Lipasa Pankreas von Schweinen untersuchte. Nachfolgende Studien zeigten die Existenz vieler anderer systemischer Lipasen in lebenden Organismen.
Die wichtigsten Lipasen bei Tieren sind Verdauungslipasen, die von der Bauchspeicheldrüse und der Leber erzeugt werden, die am Stoffwechsel der in der Ernährung konsumierten Fette regelmäßig verbraucht sind und daher wichtige physiologische Auswirkungen aus verschiedenen Sicht aufweisen.
Gegenwärtig werden diese Enzyme nicht nur für klinische und/oder metabolische Zwecke untersucht, sondern auch industriell für kommerzielle Zwecke für Lebensmittelverarbeitung und andere Produkte produzieren und aus dem Anbau spezieller Mikroorganismen erhalten werden.
[TOC]
Eigenschaften
Lipasas sind wasserlösliche Proteine und katalysierende hydrolytische Reaktionen in unlöslichen Substraten. Sie sind in der Natur in einem Gleichgewicht zwischen ihrer aktiven Form und ihrer inaktiven Form und ihrer Aktivierung oder der Inaktivierung von verschiedenen internen Faktoren ab.
Kann Ihnen dienen: Glucans: Struktur, Eigenschaften und FunktionenSie gehören zur Hydrolysase -Enzym -Superfamilie mit α/β -Falten, wobei Matten, Thioesterae, einige Proteasen und Peroxidasen, Defalus und andere intrazelluläre Hydrolasen klassifiziert werden.
Lipasen werden von Genen kodiert, die zu einer Familie gehören, die die kodierenden Gene der Pankreaslipase, der Lipase -Lipase, der Lipoprotikerlipase, der Endothellipase und der Phosphatidylserin -Phospholipase A1 umfasst.
Katalytischer Mechanismus
Einige Autoren schlagen vor, dass die Form der Katalyse, die diese Enzyme haben.
Der Hydrolysemechanismus impliziert die Bildung eines Enzym-Substratkomplexes (Lipase: Triglycerid), anschließend die Bildung eines Hemiacetal-Vermittlers und dann die Freisetzung eines Diacylglycerids und einer Fettsäure.
Der letzte Schritt der Hydrolyse, die Freisetzung von Fettsäure aus dem aktiven Zentrum katalytisch.
Substratspezifität
Lipasen können spezifisch sein und zwischen Substraten wie Triglyceriden, Diacylglyceriden, Monoglyceriden und Phospholipiden unterscheiden. Einige sind spezifisch in Fettsäuren, dh in Bezug auf ihre Länge, ihren Sättigungsgrad usw.
Sie können auch in Bezug auf die Region, in der die Hydrolysekatalysen katalysiert, selektiv sein. Dies bedeutet, dass sie in Bezug auf die Stelle, an der die Fettsäuremoleküle (in einer der drei Kohlenstoffe) (in einer der drei Kohlenstoffe) die Fettsäuremoleküle verbunden sind, eine positionelle Spezifität aufweisen können, die sie in Bezug auf die Stelle haben können, die eine Positionsspezifität haben können.
Struktur
Sowie die anderen Mitglieder der enzymatischen Familie, zu der sie gehören, sind die Lipasen durch eine Topologie gekennzeichnet, die aus α- und β-platten Blättern besteht. Die katalytische Stelle dieser Enzyme besteht im Allgemeinen aus einer Triade von Aminosäuren: Serin, Asparter oder Glutaminsäure und Histidin.
Kann Ihnen dienen: AutopoeseDie meisten Lipasen sind Glykoproteine, die je nach Größe des Kohlenhydratanteils zwischen 50 und 70 kDa -Molekulargewicht aufweisen.
Menschliche Pankreaslipase
Es verfügt über 449 Aminosäureabfälle und zwei getrennte Domänen: eine N-terminale, wobei die katalytische Stelle und die charakteristische Falte der Hydrolasen (α/β) und eine andere C-terminale, kleiner und kleiner und als „Auxiliary“ angesehen werden, mit einer Struktur genannt "Sandwich β".
Sein Molekulargewicht liegt zwischen 45 und 53 kDa, und seine katalytische Aktivität ist bei Temperaturen nahe 37 ° C und pH zwischen 6 und 10 und 10 höher.
Funktionen
Abhängig vom Organ, wo es sich in Säugetieren befindet, übt beispielsweise Lipasen etwas unterschiedliche physiologische Funktionen aus.
Wie bereits erwähnt, gibt es in der Bauchspeicheldrüse bestimmte Lipasas, die Leber, die Eierstöcke und die Nebennieren (in den Nieren) und in Endothelgeweben.
Leberlipasen sind für den Metabolismus von lipoprotischen Partikeln verantwortlich, die komplex sind, die durch Lipide und Proteine gebildet werden, die haupt.
Insbesondere beteiligen sich Lipasen an der Hydrolyse oder Freisetzung von Fettsäuren aus den in Lipoproteinen enthaltenen Triglyceridmolekülen. Dies ist notwendig, um Energie aus diesen Molekülen zu extrahieren oder sie zu recyceln, indem sie sie als Vorläufer in der Synthese anderer Verbindungen verwenden.
Endothellipasen sind in Leber, Lungen, Schilddrüsen und in den Fortpflanzungsorganen vorhanden, und die Expression ihrer Gene wird durch verschiedene Zytokine reguliert. Diese Enzyme nehmen auch am Lipoproteinstoffwechsel beteiligt.
Industriefunktionen
In der Molkereiproduktionsindustrie ist die Verwendung von Lipasen üblich.
Kann Ihnen dienen: Glyceraldehyd 3-phosphat (G3P): Struktur, FunktionenSie werden auch bei der Herstellung anderer Lebensmittelprodukte, insbesondere während der Fermentation, verwendet, um den Geschmack und die "Verdaulichkeit" einiger Mahlzeiten für Lebensmittelvorbereitung zu verbessern.
Weit entfernt von der Lebensmittelindustrie ist die Verwendung von Lipasen mikrobieller Herkunft bei der Formulierung allgemeiner Reinigungswaschmittel und Substanzen, die die schädlichen Auswirkungen auf die Umwelt verringern, die die enorme chemische Belastung in herkömmlichen Reinigungsprodukten mit sich bringt.
Verweise
- Lowe, m. UND. (2002). Die Triglycerid -Lipasen der Bauchspeicheldrüse. Journal of Lipid Research, 43, 2007-2016.
- Mead, j. R., Irvine, s. ZU., & Ramji, D. P. (2002). Lipoproteinlipase: Struktur, Funktion, Regulation und Rolle bei der Krankheit. J. Mol. Med., 80, 753-769.
- Perret, b., Mabilil, l., Martinez, l., Drittens, f., Barbaras, r., & Collet, x. (2002). Leberische Lipase: Struktur / Funktionsbeziehung, Synthese und Regulation. Journal of Lipid Research, 43, 1163-1169.
- Santamarina-Fojo, s., González-Navarro, h., Freeman, l., Wagner, e., Santamarina-Fojo, s., Gonza, h.,... nong, z. (2004). Leberlipase, Lipoproteinstoffwechsel und Atherogenese. Arteriosklerose, Thrombose und Gefäßbiologie, 24, 1750-1754.
- Taylor, p., Kurtovic, ich., Marshall, s. N., Zhao, x., Simpson, geb. K., Kurtovic, ich.,… Zhao, x. Yo. N. (2012). Lipasen von Säugetieren und Fischen. Bewertungen in der Fischereiwissenschaft, 29, 37-41.
- « Definition, Bedingungen, Übungen ohne Koplanare Vektoren
- Ausrüstungsvektoren Definition, Notation, Übungen »

